Opracowali: dr med. Piotr Gajewski i dr med. Wiktoria Leśniak
Konsultował prof. dr hab. med. Andrzej Budaj, Klinika Kardiologii Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Od Redakcji: W niniejszym artykule przedstawiono wybrane praktyczne informacje i zalecenia dotyczące rozpoznawania i leczenia świeżego zawału serca z uniesieniem odcinka ST. Po każdym zaleceniu podano w nawiasach kwadratowych jego siłę i jakość danych, na których je oparto, według klasyfikacji przedstawionej w tabeli.
Skróty: ACEI – inhibitor(y) konwertazy angiotensyny, ARB – bloker(y) receptora angiotensynowego, ASA – kwas acetylosalicylowy, BMS – stent metalowy, CABG – pomostowanie aortalno-wieńcowe, ChW – choroba wieńcowa, DES – stent uwalniający lek, EKG – elektrokardiogram, HbA1c – hemoglobina glikowana, HNF – heparyna niefrakcjonowana, LBBB – blok lewej odnogi pęczka Hisa, MR – rezonans magnetyczny, PCI – przezskórna interwencja wieńcowa, STEMI – zawał serca z uniesieniem odcinka ST, TK – tomografia komputerowa
Rozpoznanie świeżego zawału serca z uniesieniem odcinka ST
Niniejsze wytyczne odnoszą się do chorych z podmiotowymi objawami niedokrwienia mięśnia sercowego i utrzymującym się uniesieniem odcinka ST w elektrokardiogramie (EKG). U większości tych chorych występuje typowy wzrost biomarkerów martwicy mięśnia sercowego i rozwija się zawał serca z załamkiem Q.
| Klasyfikacja zaleceń i danych naukowych | |
|---|---|
| klasa (siła) zaleceń | |
| dane naukowe lub powszechnie akceptowana opinia wskazują, że określone postępowanie diagnostyczne lub lecznicze jest korzystne, użyteczne i skuteczne (co oznacza: zdecydowanie powinno się stosować daną interwencję – przyp. red.) | I |
| dane naukowe lub opinie dotyczące przydatności lub skuteczności określonego postępowania diagnostycznego lub leczniczego nie są zgodne/td> | II |
| dane naukowe lub opinie przemawiają za użytecznością lub skutecznością (co oznacza: należy rozważyć stosowanie – przyp. red.) | IIa |
| użyteczność lub skuteczność jest słabiej potwierdzona przez dane naukowe lub opinie (co oznacza: można rozważyć stosowanie – przyp. red.) | IIb |
| dane naukowe lub powszechnie akceptowana opinia wskazują, że określone postępowanie diagnostyczne lub lecznicze nie jest użyteczne ani skuteczne, a w niektórych przypadkach może być szkodliwe (co oznacza: zdecydowanie nie należy stosować danej interwencji – przyp. red.) | III |
| stopień wiarygodności danych | |
| dane pochodzące z licznych badań z randomizacją lub z metaanaliz | A |
| dane pochodzące z jednego badania z randomizacją lub z dużych badań bez randomizacji | B |
| uzgodniona opinia ekspertów lub dane pochodzące z małych badań, lub z badań retrospektywnych bądź rejestrów | C |
Aktualna definicja zawału serca
Zarówno rozpoznanie, jak i leczenie świeżego
zawału serca rozpoczyna się z chwilą pierwszego
kontaktu medycznego, definiowanego jako: 1) pierwsza
ocena pacjenta przez lekarza lub innego pracownika
medycznego w warunkach przedszpitalnych
albo 2) przybycie pacjenta na szpitalny
oddział ratunkowy. W pierwszej kolejności należy
ustalić wstępne rozpoznanie zawału serca, zwykle
na podstawie bólu w klatce piersiowej trwającego
co najmniej 20 minut i nieustępującego po przyjęciu
nitrogliceryny. Ważnymi wskazówkami
przemawiającymi za zawałem serca jest choroba
wieńcowa (ChW) w wywiadzie oraz promieniowanie
bólu do szyi, żuchwy lub lewego ramienia. Ból
nie musi być silny. U części chorych (nawet u 30%)
ze świeżym zawałem serca z uniesieniem odcinka
ST (ST-segment elevation myocardial infarction –
STEMI) występują mniej typowe objawy, takie
jak nudności lub wymioty, duszność, zmęczenie,
kołatanie serca lub omdlenie; dotyczy to częściej kobiet, chorych na cukrzycę i chorych w wieku
podeszłym.
Monitorowanie EKG należy rozpocząć tak
szybko, jak to możliwe, u wszystkich chorych z podejrzeniem STEMI, w celu wykrycia zagrażających
życiu arytmii i umożliwienia niezwłocznego
zastosowania defibrylacji, jeśli będzie konieczna.
12-odprowadzeniowy EKG powinno się uzyskać i zinterpretować możliwie jak najszybciej
po pierwszym kontakcie medycznym. EKG rzadko
jest prawidłowy, nawet we wczesnej fazie zawału
serca. Typowo w świeżym zawale serca stwierdza
się (pod warunkiem że nie występuje przerost
lewej komory ani blok lewej odnogi pęczka Hisa
[left bundle branch block – LBBB]) uniesienie
odcinka ST (mierzone w punkcie J) w dwóch
sąsiadujących odprowadzeniach wynoszące:
1) ≥0,25 mV u mężczyzn w wieku do 40 lat
2) ≥0,2 mV u mężczyzn w wieku >40 lat
3) ≥0,15 mV u kobiet w odprowadzeniach V2–V3
i/lub ≥0,1 mV w innych odprowadzeniach.
Więcej informacji na temat zmian elektrokardiograficznych w zawale serca – p. Nowa definicja zawału serca
U chorych z podejrzeniem niedokrwienia
mięśnia sercowego i z uniesieniem odcinka ST
lub nowym (lub przypuszczalnie nowym) LBBB
należy wdrożyć leczenie reperfuzyjne tak szybko,
jak to tylko możliwe. Jednakże EKG może być
niejednoznaczny we wczesnych godzinach zawału i nawet w udokumentowanych zawałach może
nigdy nie wykazywać klasycznego uniesienia
odcinka ST i nowych załamków Q. Jeśli EKG jest
niejednoznaczny lub nie potwierdza klinicznego
podejrzenia zawału serca, należy go powtórzyć i – jeśli to możliwe – porównać z wcześniejszymi
zapisami. W wybranych przypadkach pomocne w ustaleniu rozpoznania może być zarejestrowanie
EKG z dodatkowych odprowadzeń, na przykład
V7, V8 i V9.
Biomarkery we krwi oznacza się rutynowo w ostrej fazie zawału serca, ale nie należy czekać na wyniki oznaczeń, by rozpocząć leczenie reperfuzyjne. Zalecanym biomarkerem jest troponina sercowa (T lub I) ze względu na dużą czułość i dużą swoistość w odniesieniu do martwicy mięśnia sercowego. U chorych, u których kliniczne prawdopodobieństwo trwającego niedokrwienia mięśnia sercowego jest małe lub pośrednie i dolegliwości utrzymują się przez dłuższy czas, ujemny wynik oznaczenia troponiny może pomóc uniknąć niepotrzebnej pilnej koronarografii.
W razie wątpliwości co do rozpoznania rozwijającego się zawału serca badania obrazowe wykonane niezwłocznie (bez czekania, aż stwierdzi się wzrost biomarkerów we krwi) pozwalają na odpowiednio wczesne zastosowanie leczenia reperfuzyjnego. Postępowaniem z wyboru jest koronarografia wykonana w trybie pilnym (pod warunkiem że jest dostępna), ponieważ pozwala wykonać pierwotną przezskórną interwencję wieńcową (PCI), jeśli rozpoznanie się potwierdzi. Jeśli istnieją wątpliwości diagnostyczne, można wykonać echokardiografię dwuwymiarową (pod warunkiem że nie opóźni to przeniesienia chorego) – szybkie potwierdzenie odcinkowych nieprawidłowości ruchu ściany serca (występują w ciągu minut od zamknięcia tętnicy wieńcowej, znacznie wyprzedzając martwicę) może pomóc w podjęciu decyzji o niezwłocznym przetransportowaniu chorego do ośrodka, w którym można wykonać PCI. Jednakże nieprawidłowości ruchu ściany serca nie są swoiste dla świeżego zawału serca i mogą być spowodowane innymi przyczynami, takimi jak niedokrwienie mięśnia sercowego, wcześniej przebyty zawał serca lub bloki przewodzenia śródkomorowego. Echokardiografia dwuwymiarowa ma szczególną wartość w diagnostyce innych przyczyn bólu w klatce piersiowej, takich jak wysięk w worku osierdziowym, masywna zatorowość płucna czy rozwarstwienie aorty wstępującej. Niewystępowanie nieprawidłowości ruchu ściany serca wyklucza większy zawał. Na oddziale ratunkowym rola tomografii komputerowej (TK) powinna być ograniczona do rozpoznania ostrego rozwarstwienia aorty lub zatorowości płucnej.
Kardiomiopatia związana ze stresem (takotsubo) może być trudna do odróżnienia od świeżego zawału serca, ponieważ objawy podmiotowe i przedmiotowe (od lekkiego bólu w klatce piersiowej po wstrząs kardiogenny) mogą go naśladować, ale zmiany w EKG w chwili przyjęcia chorego są zwykle niewielkie i nie korelują z ciężkością dysfunkcji komory. Kardiomiopatia ta charakteryzuje się typowym przemijającym rozszerzeniem i dysfunkcją skurczową serca w okolicy koniuszka lub środkowej części lewej komory. Ponieważ nie ma badania, które pozwalałoby wykluczyć zawał serca w takiej sytuacji, nie powinno się odwlekać koronarografii, która wykaże, iż nie ma istotnego zwężenia tętnicy wieńcowej ani zakrzepu wewnątrzwieńcowego. Rozpoznanie potwierdza: 1) stwierdzenie w badaniu obrazowym przemijającego balonowatego rozdęcia okolicy koniuszka do środkowej części komory z kompensacyjną hiperkinezą podstawy serca; 2) nieproporcjonalnie małe stężenie biomarkerów sercowych we krwi w stosunku do ciężkości dysfunkcji komory; 3) powrót czynności lewej komory.
Zalecenia dotyczące wstępnego rozpoznania świeżego zawału serca
1. Zaleca się:
1) wykonanie 12-odprowadzeniowego EKG tak
szybko, jak to możliwe, podczas pierwszego kontaktu
medycznego, najlepiej w ciągu ≤10 minut [I/B]
2) jak najwcześniejsze rozpoczęcie monitorowania
EKG u wszystkich chorych z podejrzeniem
STEMI [I/B]
3) pobranie próbek krwi w celu oznaczenia biomarkerów w ostrej fazie zawału, ale nie należy
czekać z rozpoczęciem leczenia reperfuzyjnego
na wyniki oznaczeń [I/C].
2. Należy rozważyć zarejestrowanie EKG z dodatkowych odprowadzeń tylnych (V7–V9 ≥0,05
mV) u chorych z silnym podejrzeniem zawału
ściany dolnopodstawnej (zamknięcie gałęzi okalającej
lewej tętnicy wieńcowej) [IIa/C].
3. Można rozważyć wykonanie echokardiografii w celu ustalenia rozpoznania w przypadkach
wątpliwych, ale nie powinno to opóźnić
przeniesienia chorego w celu wykonania koronarografii
[IIb/C].
Leczenie chorych
Algorytm postępowania przedstawiono na rycinie.
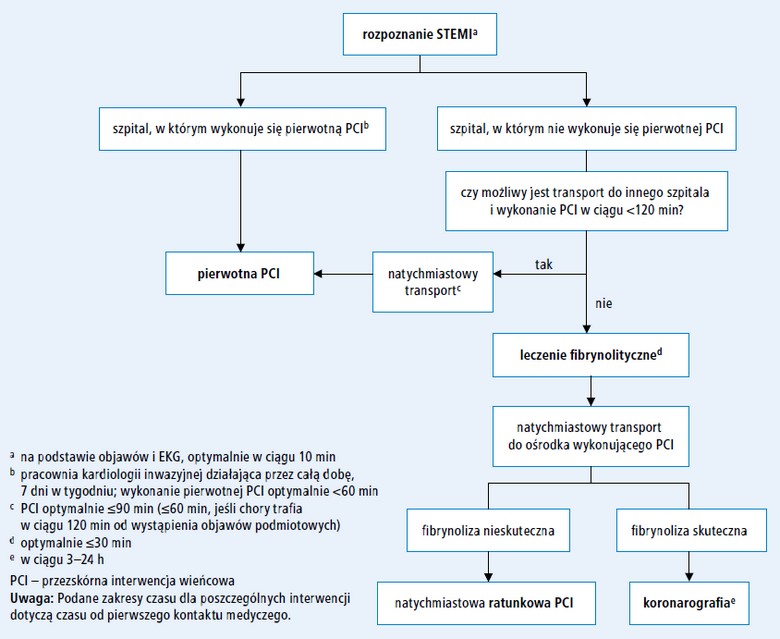
Ryc. Algorytm postępowania u chorych ze STEMI w ciągu 24 godzin od pierwszego kontaktu medycznego (na podstawie wytycznych ESC 2012, zmodyfikowane)
Zalecenia dotyczące zwalczania bólu, duszności i lęku
1. Zaleca się:
1) stosowanie w celu zniesienia bólu opioidów
(np. morfiny) dożylnie w miareczkowanych
dawkach [I/C]. Należy unikać wstrzyknięć
domięśniowych. Do skutków ubocznych należą:
nudności i wymioty, hipotensja z bradykardią
oraz depresja oddychania. Można jednocześnie
podać lek przeciwwymiotny. Hipotensja i bradykardia
zwykle ustępują po podaniu atropiny, a depresja oddychania po podania naloksonu
(0,1–0,2 mg i.v. co 15 min w razie potrzeby; lek
ten zawsze powinien być dostępny).
2) stosowanie tlenu u chorych z hipoksemią (SaO2
<95%), dusznością lub ostrą niewydolnością
serca [I/C].
2. Należy rozważyć zastosowanie leku uspokajającego u chorych odczuwających silny lęk
[IIa/C].
Zalecenia dotyczące postępowania w zatrzymaniu czynności serca
1. Zaleca się:
1) aby wszyscy pracownicy medyczni opiekujący
się chorymi z podejrzeniem zawału serca mieli
dostęp do defibrylatora i byli przeszkoleni w czynnościach reanimacyjnych [I/C].
2) rozpoczęcie monitorowania EKG z chwilą
pierwszego kontaktu medycznego u wszystkich
chorych z podejrzeniem zawału serca [I/C]
3) zastosowanie terapeutycznej hipotermii wcześnie
po resuscytacji chorego z zatrzymaniem
czynności serca, który jest w śpiączce lub w głębokiej
sedacji [I/B]
4) niezwłoczne wykonanie koronarografii, z zamiarem
wykonania pierwotnej PCI, u chorych zresuscytowanych
po zatrzymaniu czynności serca, u których EKG wykazuje STEMI [I/B].
2. Należy rozważyć niezwłoczne wykonanie
koronarografii, z zamiarem wykonania pierwotnej
PCI, u chorych, którzy przeżyli zatrzymanie
czynności serca bez diagnostycznego uniesienia
odcinka ST w EKG, ale z silnym podejrzeniem
świeżego zawału serca [IIa/B].
Zalecenia dotyczące logistyki opieki przedszpitalnej
1. Zespoły pogotowia ratunkowego muszą
być odpowiednio przeszkolone i wyposażone, by
mogły wykryć STEMI (używając rejestratorów
EKG i telemetrii, jeśli to konieczne) i zastosować
wstępne leczenie, w tym trombolizę (jeśli będzie
wskazana) [I/B].
2. Postępowanie przedszpitalne z chorymi
ze STEMI musi się opierać na regionalnej sieci
zaprojektowanej, tak aby chorzy mogli otrzymać
leczenie reperfuzyjne szybko i skutecznie i aby
można było wykonać pierwotną PCI u możliwie
jak największej liczby chorych [I/B].
3. Ośrodki, w których wykonuje się pierwotną
PCI, powinny działać 24 godziny na dobę przez 7 dni w tygodniu, tak aby rozpocząć pierwotną
PCI jak najszybciej, ale zawsze w ciągu 60 minut
od pierwszego powiadomienia [I/B].
4. Wszystkie szpitale i zespoły pogotowia
ratunkowego uczestniczące w opiece nad chorymi
ze STEMI muszą odnotowywać i monitorować
czasy opóźnienia i dążyć do osiągnięcia i utrzymania
następujących celów:
1) czas od pierwszego kontaktu medycznego
do pierwszego EKG ≤10 minut
2) czas od pierwszego kontaktu medycznego do rozpoczęcia
leczenia reperfuzyjnego – dla fibrynolizy
≤30 minut, dla pierwotnej PCI ≤90 minut
(≤60 min, jeśli pacjent trafia w ciągu 120 min
od wystąpienia objawów podmiotowych lub bezpośrednio
do szpitala, w którym wykonuje się PCI) [I/B].
5. Wszystkie oddziały ratunkowe i oddziały
intensywnej terapii kardiologicznej muszą mieć
spisany protokół postępowania w STEMI, zgodny z aktualnymi wytycznymi, najlepiej taki sam w danej sieci placówek [I/C].
6. Chorzy trafiający do szpitala, w którym
nie wykonuje się PCI, i oczekujący na przewiezienie
do placówki w celu wykonania pierwotnej
lub ratunkowej PCI, muszą przebywać w miejscu,
gdzie jest zapewnione odpowiednie monitorowanie
[I/C].
7. Chorzy przewiezieni do ośrodka wykonującego
PCI w celu wykonania pierwotnej PCI
powinni trafić bezpośrednio do pracowni hemodynamicznej z pominięciem oddziału ratunkowego
[IIa/B].
Zalecenia dotyczące leczenia reperfuzyjnego
1. Zaleca się:
1) leczenie reperfuzyjne u wszystkich chorych z objawami podmiotowymi trwającymi <12
godzin i z utrzymującym się uniesieniem
odcinka ST lub z nowym (także przypuszczalnie
nowym) LBBB [I/A]
2) leczenie reperfuzyjne (najlepiej pierwotną PCI),
jeśli są dowody na utrzymywanie się niedokrwienia
mięśnia sercowego, nawet jeśli objawy
podmiotowe wystąpiły przed ponad 12 godzinami
lub gdy ból i zmiany w EKG pojawiają się i ustępują [I/C].
2. Można rozważyć pierwotną PCI u chorych w stanie stabilnym, gdy od wystąpienia objawów
podmiotowych upłynęło 12–24 godzin [IIb/B].
3. Nie zaleca się rutynowego wykonywania
PCI w całkowicie zamkniętej tętnicy po upływie
24 godzin od wystąpienia objawów podmiotowych u chorych w stanie stabilnym bez objawów przedmiotowych
niedokrwienia mięśnia sercowego
(niezależnie od tego czy otrzymali leczenie fibrynolityczne)
[III/A].
4. Pożądane czasy interwencji od pierwszego
kontaktu medycznego:
1) do wykonania EKG i ustalenia rozpoznania – do 10 minut
2) do rozpoczęcia leczenia fibrynolitycznego – do 30 minut
3) do pierwotnej PCI
a) w szpitalach, w których wykonuje się taki zabieg – do 60 minut
b) w pozostałych przypadkach – do 90 minut (60 minut, jeśli chory trafia wcześnie z dużym
zagrożonym obszarem mięśnia sercowego)
c) zamiast fibrynolizy – do 120 minut (90 min,
jeśli chory trafia wcześnie z dużym zagrożonym
obszarem mięśnia sercowego); jeśli
zwłoka byłaby dłuższa, należy rozważyć
fibrynolizę.
Czas od skutecznej fibrynolizy do wykonania
koronarografii powinien wynosić 3–24 godzin.
Zalecenia dotyczące pierwotnej PCI
1. Zaleca się:
1) pierwotną PCI zamiast fibrynolizy, jeśli zabieg
wykona doświadczony zespół w ciągu 120 minut
od pierwszego kontaktu medycznego [I/A]
2) pierwotną PCI u chorych z ciężką ostrą niewydolnością
serca lub ze wstrząsem kardiogennym,
pod warunkiem że spodziewane opóźnienie
związane z PCI nie będzie zbyt długie i od wystąpienia objawów podmiotowych upłynęło
niewiele czasu [I/B]
3) pierwotną PCI z wszczepieniem stentu, a nie
samą angioplastykę balonową [I/A].
2. Należy rozważyć:
1) ograniczenie pierwotnej PCI do naczynia odpowiedzialnego
za zawał, z wyjątkiem wstrząsu kardiogennego i utrzymującego się niedokrwienia
mięśnia sercowego po PCI w zakresie
zmiany podejrzewanej o spowodowanie zawału
[IIa/B]
2) wykonanie zabiegu z dojścia promieniowego, a nie udowego, pod warunkiem że operator ma
odpowiednie doświadczenie [IIa/B]
3) wszczepienie stentów uwalniających lek (DES)
zamiast stentów metalowych (BMS), jeśli
chory nie ma przeciwwskazań do długotrwałej
podwójnej terapii przeciwpłytkowej (tj. nie ma
wskazania do leczenia doustnym antykoagulantem
ani dużego oszacowanego długoterminowego
ryzyka krwawienia) i prawdopodobnie
będzie przestrzegał zaleceń lekarskich [IIa/A]
4) rutynową aspirację zakrzepu [IIa/B].
3. Nie zaleca się rutynowego stosowania:
1) urządzeń do protekcji dystalnej [III/C]
2) kontrapulsacji wewnątrzaortalnej u chorych
bez wstrząsu [III/A].
Zalecenia dotyczące okołozabiegowego stosowania leków przeciwzakrzepowych w pierwotnej PCI
Leczenie przeciwpłytkowe
1. Zaleca się stosowanie:
1) kwasu acetylosalicylowego (ASA) doustnie lub
dożylnie (u chorych, którzy nie są w stanie połykać
tabletek) [I/B]
2) blokera receptora ADP (w połączeniu z ASA) [I/A]
a) prasugrelu u chorych w wieku <75 lat, nieprzyjmujących
dotychczas klopidogrelu, u których nie wystąpił wcześniej udar mózgu
ani napad przemijającego niedokrwienia
mózgu [I/B]
b) tikagreloru [I/B]
c) klopidogrelu, jeśli prasugrel i tikagrelor są
niedostępne lub przeciwwskazane [I/C].
2. Należy rozważyć zastosowanie blokera GP
IIb/IIIa jako leczenia ratunkowego, jeśli w koronarografii
stwierdza się masywny zakrzep, wolny
przepływ lub brak powrotu przepływu, bądź powikłanie
zakrzepowe [IIa/C].
3. Można rozważyć:
1) rutynowe stosowanie blokera GP IIb/IIIa u chorych
poddawanych pierwotnej PCI z zastosowaniem
heparyny niefrakcjonowanej (HNF), jeśli
nie ma przeciwwskazań [IIb/B]
2) wcześniejsze (a nie w pracowni hemodynamicznej
tuż przed zabiegiem) stosowanie blokera GP
IIb/IIIa u chorych z grupy dużego ryzyka transportowanych w celu wykonania pierwotnej PCI [IIb/B].
Można zastosować jeden z następujących blokerów
GP IIb/IIIa: abciksymab [A], eptifibatyd
(z podwójną dawką nasycającą) [B] lub tirofiban
(z dużą dawką nasycającą) [B].
Leki przeciwkrzepliwe
1. Zaleca się stosowanie:
1) leku przeciwkrzepliwego pozajelitowo w przypadku
pierwotnej PCI [I/C]
2) biwalirudyny (zamiast HNF i blokera GP IIb/IIIa); przy jej stosowaniu bloker GP IIb/IIIa
można podać tylko jako leczenie ratunkowe [I/B]
3) HNF (z blokerem GP IIb/IIIa lub bez tego leku) u chorych nieotrzymujących biwalirudyny
lub enoksaparyny [I/C].
2. Można rozważyć preferowanie enoksaparyny (z blokerem GP IIb/IIIa lub bez tego leku)
zamiast HNF [IIb/B].
3. Nie zaleca się stosowania:
1) fondaparynuksu u chorych poddawanych pierwotnej PCI [III/B]
2) fibrynolizy przed planowaną pierwotną PCI [III/A].
Przeciwwskazania do leczenia fibrynolitycznego
1. Przeciwwskazania bezwzględne
1) przebyty kiedykolwiek krwotok wewnątrzczaszkowy
lub udar mózgu o nieznanej przyczynie
2) udar niedokrwienny mózgu przebyty w ciągu
ostatnich 6 miesięcy
3) uszkodzenie, nowotwór lub malformacja tętniczo-żylna ośrodkowego układu nerwowego
4) poważny uraz lub operacja, lub obrażenia głowy w ciągu ostatnich 3 tygodni
5) krwawienie do przewodu pokarmowego w ciągu
ostatniego miesiąca
6) znana skaza krwotoczna (z wyłączeniem miesiączek)
7) rozwarstwienie aorty
8) nakłucie w miejscu niedającym się ucisnąć,
wykonane w ciągu ostatnich 24 godzin (np. biopsja
wątroby, nakłucie lędźwiowe)
2. Przeciwwskazania względne
1) napad przemijającego niedokrwienia mózgu w ciągu ostatnich 6 miesięcy
2) leczenie doustnym antykoagulantem
3) ciąża i pierwszy tydzień połogu
4) oporne nadciśnienie tętnicze (ciśnienie tętnicze
skurczowe >180 mm Hg i/lub ciśnienie rozkurczowe >110 mm Hg)
5) zaawansowana choroba wątroby
6) infekcyjne zapalenie wsierdzia
7) czynny wrzód trawienny
8) przedłużona lub urazowa resuscytacja.
Zalecenia dotyczące leczenia fibrynolitycznego
Zaleca się stosowanie:
1) leczenia fibrynolitycznego w ciągu 12 godzin
od wystąpienia objawów podmiotowych u chorych
bez przeciwwskazań, jeśli pierwotna PCI
nie może być wykonana przez doświadczony
zespół w ciągu 120 minut od pierwszego kontaktu
medycznego [I/A]. U chorych w okresie do 2 godzin od wystąpienia objawów podmiotowych, z dużym zawałem i małym ryzykiem krwawienia,
należy rozważyć leczenie fibrynolityczne,
jeśli czas od pierwszego kontaktu medycznego
do napełnienia balonu wynosi >90 minut [IIa/B].
Jeśli to jest możliwe, leczenie fibrynolityczne
należy rozpocząć przed przywiezieniem chorego
do szpitala [IIa/A]. Należy preferować leki swoiste
dla fibryny (tenekteplaza, alteplaza, reteplaza), a nie leki nieswoiste [I/B].
2) ASA (doustnie lub dożylnie) [I/B] w połączeniu z klopidogrelem [I/A].
Zalecenia dotyczące leczenia przeciwtrombinowego u chorych otrzymujących leczenie fibrynolityczne
1. U chorych ze STEMI otrzymujących leczenie
fibrynolityczne zaleca się do czasu rewaskularyzacji
(jeśli się ją wykonuje) lub podczas hospitalizacji
do 8 dni stosowanie leku przeciwkrzepliwego
[I/A]:
1) enoksaparyny dożylnie, a następnie podskórnie
(lek preferowany) [I/A] albo
2) HNF w dawce dostosowanej do masy ciała
we wstrzyknięciu dożylnym, a następnie
we wlewie dożylnym [I/C].
2. U chorych leczonych streptokinazą należy rozważyć
zastosowanie fondaparynuksu we wstrzyknięciu
dożylnym i następnie podanie dawki podskórnej
po 24 godzinach [IIa/B].
Zalecenia dotyczące interwencji po leczeniu fibrynolitycznym
1. Zaleca się przewiezienie wszystkich chorych
po leczeniu trombolitycznym do ośrodka, w którym
wykonuje się PCI [I/A].
2. Zaleca się wykonanie:
1) ratunkowej PCI niezwłocznie po stwierdzeniu
nieskuteczności leczenia fibrynolitycznego (po 60 min obniżenie uniesionego odcinka ST o <50%) [I/A]
2) pilnej PCI w przypadku nawracającego niedokrwienia
mięśnia sercowego lub objawów
ponownego zamknięcia tętnicy po początkowo
udanej fibrynolizie [I/B]
3) pilnej koronarografii, z zamiarem rewaskularyzacji, u chorych z niewydolnością serca lub
we wstrząsie [I/A]
4) koronarografii, z zamiarem rewaskularyzacji
tętnicy odpowiedzialnej za zawał, po udanej
fibrynolizie [I/A].
3. Koronarografię u chorych w stanie stabilnym
po udanej fibrynolizie najlepiej wykonać po upływie 3–24 godzin [IIa/A].
Dawkowanie leków fibrynolitycznych
1. Streptokinaza: 1,5 mln j. w ciągu 30–60
minut dożylnie (nie stosować, jeśli pacjent wcześniej
otrzymywał streptokinazę lub anistreplazę).
2. Alteplaza (tPA): 15 mg we wstrzyknięciu
dożylnym, 0,75 mg/kg w ciągu 30 minut (do 50 mg),
następnie 0,5 mg/kg w ciągu 60 minut dożylnie
(do 35 mg).
3. Reteplaza (r-PA): 2 wstrzyknięcia dożylne
po 10 j. w odstępie 30 minut.
4. Tenekteplaza (TNK-tPA): pojedyncze
wstrzyknięcie dożylne: u chorych o masie ciała
<60 kg – 30 mg; 60 do <70 – 35 mg; 70 do <80 kg –
40 mg; 80 do <90 kg – 45 mg; ≥90 kg – 50 mg.
Dawkowanie leków przeciwpłytkowych
Chorzy poddawani pierwotnej PCI
1. ASA: dawka nasycająca 150–300 mg doustnie
lub 80–150 mg dożylnie (jeśli chory nie może
przyjmować leków doustnie), następnie dawka
podtrzymująca 75–100 mg/d.
2. Klopidogrel: dawka nasycająca 600 mg
doustnie, następnie dawka podtrzymująca
75 mg/d.
3. Prasugrel: dawka nasycająca 60 mg doustnie,
następnie dawka podtrzymująca 10 mg/d; u chorych o masie ciała <60 kg zaleca się dawkę
podtrzymującą 5 mg/d; u chorych w wieku >75 lat
zasadniczo nie zaleca się stosowania prasugrelu,
ale jeśli uzna się to za konieczne, należy stosować
dawkę 5 mg/d.
4. Tikagrelor: dawka nasycająca 180 mg
doustnie, następnie dawka podtrzymująca 90 mg 2 razy dziennie.
5. Abciksymab: dawka nasycająca 0,25 mg/kg
dożylnie, następnie 0,125 µg/kg/min we wlewie
(maks. 10 µg/min) przez 12 godzin.
6. Eptifibatyd: 2 wstrzyknięcia nasycające
po 180 µg/kg dożylnie w odstępie 10 minut, następnie
wlew 2,0 µg/kg/min przez 18 godzin.
7. Tirofiban: 25 µg/kg dożylnie we wstrzyknięciu
trwającym 3 minuty, następnie wlew podtrzymujący
0,15 µg/kg/min przez 18 godzin.
Chorzy otrzymujący leczenie fibrynolityczne
1. ASA: dawka początkowa 150–500 mg doustnie
lub 250 mg dożylnie (jeśli chory nie może
przyjmować leku doustnie).
2. Klopidogrel: dawka nasycająca 300 mg
doustnie u chorych w wieku ?75 lat, następnie
dawka podtrzymująca 75 mg/d.
Chorzy niepoddawani leczeniu reperfuzyjnemu
1. ASA: dawka początkowa 150–500 mg doustnie
2. Klopidogrel: 75 mg/d doustnie.
Dawkowanie leków przeciwtrombinowych
Chorzy poddawani pierwotnej PCI
1. HNF: 70–100 j./kg we wstrzyknięciu dożylnym,
jeśli się nie planuje zastosowania blokera GP
IIb/IIIa; 50–60 j./kg we wstrzyknięciu dożylnym
razem z blokerem GP IIb/IIIa.
2. Enoksaparyna: 0,5 mg/kg we wstrzyknięciu dożylnym.
3. Biwalirudyna: 0,75 mg/kg we wstrzyknięciu
dożylnym, następnie 1,75 mg/kg/h we wlewie
dożylnym przez 4 godziny po zabiegu, jeśli jest
to klinicznie uzasadnione; po zaprzestaniu tego
wlewu można kontynuować wlew 0,25 mg/kg/h
przez 4–12 godzin, jeśli jest to konieczne ze względów
klinicznych.
Chorzy otrzymujący leczenie fibrynolityczne
1. HNF: 60 j./kg we wstrzyknięciu dożylnym
(maks. 4000 j.), następnie wlew dożylny 12 j./kg
(maks. 1000 j./h) przez 24–48 godzin; docelowa wartość APTT: 50–70 s lub 1,5–2,0 razy wartość
kontrolna, z kontrolnymi oznaczeniami po 3, 6, 12 i 24 godzinach.
2. Enoksaparyna: u chorych w wieku <75 lat
30 mg we wstrzyknięciu dożylnym, następnie
po upływie 15 minut 1 mg/kg podskórnie co 12
godzin do wypisania ze szpitala przez maksymalnie 8 dni; 2 pierwsze dawki nie powinny przekraczać
100 mg. U chorych w wieku >75 lat bez początkowego
wstrzyknięcia dożylnego należy rozpocząć
od dawki podskórnej 0,75 mg/kg, pierwsze 2 dawki
podskórne nie powinny przekraczać 75 mg; u chorych z klirensem kreatyniny <30 ml/min, niezależnie
od wieku, dawki podskórne należy podawać
co 24 godziny.
3. Fondaparynuks: 2,5 mg we wstrzyknięciu
dożylnym, następnie wstrzyknięcia podskórne
2,5 mg raz dziennie przez 8 dni lub do wypisania
ze szpitala.
Chorzy niepoddawani leczeniu reperfuzyjnemu
HNF lub enoksaparyna, lub fondaparynuks w takich samych dawkach jak u chorych otrzymujących leczenie fibrynolityczne.
Zalecane początkowe dawkowanie leków przeciwzakrzepowych u chorych z przewlekłą chorobą nerek (oszacowany klirens kreatyniny <60 ml/min)
1. Nie ma potrzeby dostosowywania dawek:
1) ASA
2) klopidogrelu
3) prasugrelu (nie ma danych dotyczących chorych ze schyłkową niewydolnością nerek i chorych
dializowanych)
4) tikagreloru (uwaga jw.)
5) enoksaparyny we wstrzyknięciu (u chorych po leczeniu fibrynolitycznym z klirensem kreatyniny
<30 ml/min dawki podskórne należy podawać co 24 h)
6) HNF we wstrzyknięciu
7) fondaparynuksu (nie ma danych dotyczących
chorych ze schyłkową chorobą nerek i chorych
dializowanych)
8) abciksymabu (należy starannie rozważyć
ryzyko krwawienia).
2. Biwalirudyna: u chorych z umiarkowaną niewydolnością
nerek (GFR 30–59 ml/min) powinno
się zmniejszyć początkowy wlew do 1,4 mg/kg/h
(wstrzyknięcie nasycające pozostaje niezmienione); u chorych z ciężką niewydolnością nerek (GFR
<30 ml/min) i u chorych dializowanych biwalirudyna
jest przeciwwskazana.
3. Eptifibatyd: u chorych z umiarkowaną niewydolnością
nerek (GFR >30 i <50 ml/min) należy
podać dawkę nasycającą we wstrzyknięciu dożylnym
180 µg, a następnie w ciągłym wlewie dawkę
1,0 µg/kg/min przez cały czas leczenia; u chorych z ciężką niewydolnością nerek (GFR <30 ml/min)
eptifibatyd jest przeciwwskazany.
4. Tirofiban: u chorych z ciężką niewydolnością
nerek (GFR <30 ml/min) dawkę podawaną we wlewie
powinno się zmniejszyć o 50%.
Zalecenia dotyczące postępowania w hiperglikemii u chorych z zawałem serca z uniesieniem odcinka ST
1. Zaleca się:
1) pomiary glikemii w ramach wstępnej oceny
wszystkich chorych oraz powtarzane pomiary u chorych z rozpoznaną cukrzycą lub hiperglikemią
[I/C]
2) opracowanie planu optymalnej kontroli glikemii i wtórnej prewencji przed wypisaniem chorego
na cukrzycę ze szpitala [I/C].
Docelowe stężenie glukozy we krwi w ostrej
fazie zawału serca powinno wynosić ≤11,0 mmol/l
(200 mg/dl) przy jednoczesnym unikaniu spadku
glikemii <5 mmol/l (90 mg/dl).
2. Należy rozważyć:
1) u niektórych chorych, w celu osiągnięcia docelowej
glikemii – stosowanie insuliny we wlewie w dawce dostosowywanej, z jednoczesnym monitorowaniem
glikemii, pod warunkiem że unika
się hipoglikemii [IIa/B]
2) u chorych z hiperglikemią, ale bez cukrzycy w wywiadach – oznaczenie stężenia glukozy
na czczo i odsetka HbA1c, a w niektórych przypadkach
wykonanie doustnego testu tolerancji
glukozy po wypisaniu ze szpitala [IIa/B].
3. Nie zaleca się rutynowego stosowania
wlewu glukozy z insuliną i potasem [III/A].
Zalecenia dotyczące zagadnień logistycznych pobytu chorego w szpitalu
1. Wszystkie szpitale, w których leczy się chorych
ze STEMI, powinny mieć odpowiednio wyposażony
oddział intensywnej terapii kardiologicznej,
aby zapewnić pełną opiekę chorym, w tym leczenie
niedokrwienia mięśnia sercowego, ciężkiej niewydolności
serca, arytmii i częstych chorób współistniejących
[I/C].
2. Chorzy po niepowikłanym skutecznym leczeniu
reperfuzyjnym powinni przebywać na oddziale
intensywnej terapii kardiologicznej przez co najmniej
24 godziny, po czym mogą zostać przekazani
na oddział mniej specjalistyczny na łóżko z zapewnionym
monitorowaniem na kolejne 24–48 godzin
[I/C].
3. Wczesne przekazanie (tego samego dnia)
do szpitala bez pracowni hemodynamicznej
można rozważyć w przypadku wybranych chorych z grupy małego ryzyka po udanej pierwotnej PCI, u których nie obserwowano zaburzeń rytmu serca
[IIb/C].
4. Wczesne wypisanie ze szpitala (po ok. 72 h)
jest rozsądne u wybranych chorych z grupy małego
ryzyka, jeśli została zaplanowana wczesna rehabilitacja i odpowiednia obserwacja [IIb/B].
Zalecenia dotyczące badań obrazowych i prób obciążeniowych
1. W ostrej fazie zawału serca, gdy rozpoznanie
nie jest pewne, może być przydatne wykonanie w trybie pilnym echokardiografii. Jeśli jednak
wynik badania nie jest jednoznaczny lub badanie
to jest niedostępne, albo nadal pozostają wątpliwości
– należy rozważyć wykonanie koronarografii w trybie pilnym [I/C].
2. Po ostrej fazie zawału serca u wszystkich
chorych należy wykonać echokardiografię w celu
oceny wielkości zawału i czynności lewej komory w spoczynku [I/B]. Jeśli wykonanie echokardiografii
nie jest możliwe, alternatywnym badaniem
może być rezonans magnetyczny (MR) [IIb/C].
3. Przed wypisaniem lub po wypisaniu ze szpitala u chorych z chorobą wielonaczyniową, a także u chorych, u których rozważa się rewaskularyzację w zakresie innych naczyń niż tętnica
odpowiedzialna za zawał – wskazane jest wykonanie próby wysiłkowej lub próby obciążeniowej z badaniem obrazowym (np. obciążeniowej
scyntygrafii perfuzyjnej mięśnia sercowego,
echokardiografii obciążeniowej, PET lub MR) w celu oceny niedokrwienia i żywotności mięśnia
sercowego [I/A].
4. Angiografia techniką TK nie ma zastosowania w rutynowym postępowaniu z chorymi ze STEMI [III/C].
Zalecenia dotyczące rutynowych terapii w STEMI – leczenie w fazie ostrej i podostrej oraz leczenie przewlekłe
1. Chorym ze STEMI palącym papierosy trzeba
udzielić porady antynikotynowej i dać skierowanie
do programu leczenia uzależnienia od tytoniu
[I/B]. Taką interwencję powinny zapewniać
wszystkie szpitale, w których leczy się chorych
ze STEMI [I/C].
2. Zaleca się rehabilitację opartą na ćwiczeniach
fizycznych [I/B].
3. Po STEMI zaleca się bezterminowe stosowanie
leczenia przeciwpłytkowego z użyciem ASA w małej dawce (75–100 mg/d) [I/A].
4. U chorych, którzy nie mogą przyjmować ASA,
zaleca się stosowanie klopidogrelu [I/B].
5. U chorych poddanych PCI zaleca się stosowanie
podwójnej terapii przeciwpłytkowej z zastosowaniem
ASA i prasugrelu albo ASA i tikagreloru
(leczenie preferowane względem ASA z klopidogrelem)
[I/A].
6. Podwójne leczenie przeciwpłytkowe z zastosowaniem
ASA i doustnego antagonisty receptora
ADP trzeba kontynuować przez 12 miesięcy
po STEMI [I/C], a co najmniej przez miesiąc u chorych po wszczepieniu BMS [I/C] i przez co
najmniej 6 miesięcy u chorych po wszczepieniu
DES [IIb/B].
7. U chorych ze skrzepliną w lewej komorze
należy stosować leczenie przeciwkrzepliwe przez
co najmniej 3 miesiące [IIa/B].
8. U chorych z jednoznacznymi wskazaniami
do doustnej antykoagulacji (np. migotanie przedsionków z punktacją ≥2 w skali CHA2DS2-VASc
lub z mechaniczną protezą zastawkową) należy
stosować lek przeciwkrzepliwy w połączeniu z leczeniem przeciwpłytkowym [I/C].
9. U chorych wymagających potrójnej terapii
przeciwzakrzepowej (2 leków przeciwpłytkowych i leku przeciwkrzepliwego), na przykład z powodu
wszczepienia stentu i bezwzględnego wskazania
do stosowania doustnego antykoagulantu, należy
ograniczyć czas podwójnej terapii przeciwpłytkowej w celu zmniejszenia ryzyka krwawienia [I/C].
10. U wybranych chorych otrzymujących ASA i klopidogrel można rozważyć zastosowanie rywaroksabanu w małej dawce (2,5 mg 2 × dz.), jeśli
ryzyko krwawienia jest małe [IIb/B].
11. U chorych po STEMI, którym nie wszczepiono
stentu, powinno się stosować podwójną terapię
przeciwpłytkową przez rok [IIa/C].
12. Podczas stosowania podwójnej terapii przeciwpłytkowej u chorych z dużym ryzykiem krwawienia
należy rozważyć stosowanie inhibitora
pompy protonowej w celu ochrony błony śluzowej
żołądka i zapobiegania krwawieniu [IIa/C].
13. U wszystkich chorych ze STEMI należy rozważyć
stosowanie doustnego β-blokera w czasie
hospitalizacji i po wypisaniu ze szpitala, jeśli nie
ma przeciwwskazań [IIa/B].
14. Leczenie doustnym β-blokerem jest wskazane u chorych z niewydolnością serca lub dysfunkcją
lewej komory [I/A].
15. U chorych z hipotensją lub niewydolnością
serca trzeba unikać dożylnego podawania
β-blokerów [III/B].
16. Dożylne podawanie ß-blokera przy przyjęciu
należy rozważyć u chorych bez przeciwwskazań, z wysokim ciśnieniem krwi i/lub tachykardią, i bez objawów przedmiotowych niewydolności
serca [IIa/B].
17. U wszystkich chorych ze STEMI trzeba
tak szybko, jak to możliwe, po przyjęciu do szpitala
wykonać badanie profilu lipidowego na czczo
[I/C].
18. Zaleca się rozpoczęcie lub kontynuowanie
leczenia statyną w dużej dawce wcześnie po przyjęciu
do szpitala u wszystkich chorych ze STEMI
bez przeciwwskazań lub nietolerancji statyn w wywiadach, niezależnie od wyjściowego stężenia
cholesterolu we krwi [I/A].
19. Po upływie 4–6 tygodni należy rozważyć
ponowne oznaczenie stężenia cholesterolu frakcji
LDL w celu upewnienia się, czy została osiągnięta
wartość docelowa (≤1,8 mmol/l [70 mg/dl])
[IIa/C].
20. Zastosowanie werapamilu można rozważyć w celu wtórnej prewencji u chorych z bezwzględnymi
przeciwwskazaniami do stosowania β-blokerów i bez niewydolności serca [IIb/B].
21. Zastosowanie inhibitora konwertazy angiotensyny
(ACEI) jest wskazane już w ciągu pierwszych
24 godzin od wystąpienia STEMI u chorych z cechami niewydolności serca, ze skurczową dysfunkcją
lewej komory, z cukrzycą lub z zawałem
ściany przedniej [I/A].
22. Blokery receptora angiotensynowego (ARB;
preferowany walsartan) stanowią alternatywę dla
ACEI u chorych z niewydolnością serca lub z dysfunkcją
skurczową lewej komory, szczególnie tych,
którzy nie tolerują ACEI [I/B].
23. Zastosowanie ACEI należy rozważyć u wszystkich chorych bez przeciwwskazań
[IIa/A].
24. Zastosowanie antagonisty aldosteronu
(np. eplerenonu) jest wskazane u chorych z LVEF
?40% i z niewydolnością serca lub z cukrzycą, pod
warunkiem że nie występuje niewydolność nerek
lub hiperkaliemia [I/B].
Leczenie powikłań
Zalecenia dotyczące leczenia niewydolności serca i dysfunkcji lewej komory
Łagodna niewydolność serca (II klasa Killipa)
1. Zaleca się stosowanie:
1) tlenu – w celu utrzymania wysycenia tlenem
krwi tętniczej >95% [I/C]
2) diuretyku pętlowego (np. furosemidu 20–40 mg
dożylnie); dawkę należy powtarzać co 1–4
godzin w razie potrzeby [I/C]
3) ACEI u wszystkich chorych z objawami niewydolności
serca i/lub cechami dysfunkcji lewej
komory, jeśli nie ma hipotensji, hipowolemii i niewydolności nerek [I/A]
4) ARB (walsartanu) jako alternatywy dla ACEI,
szczególnie u chorych nietolerujących ACEI [I/B]
5) antagonisty aldosteronu (eplerenonu) u wszystkich
chorych z objawami niewydolności serca
i/lub cechami dysfunkcji lewej komory, pod
warunkiem że nie występuje niewydolność
nerek lub hiperkaliemia [I/B].
2. Należy rozważyć zastosowanie:
1) azotanu lub nitroprusydku sodu dożylnie u chorych z podwyższonym skurczowym ciśnieniem
tętniczym [IIa/C]
2) hydralazyny i diazotanu izosorbidu u chorych
nietolerujących zarówno ACEI, jak i ARB
[IIa/C].
Umiarkowana niewydolność serca (III klasa Killipa)
1. Zaleca się stosowanie:
1) tlenu [I/C]
2) wspomagania wentylacji, w zależności od wy -
niku gazometrii [I/C]
3) diuretyku pętlowego (np. furosemidu 20–40 mg
dożylnie), dawkę należy powtarzać co 1–4
godzin w razie potrzeby [I/C]
4) morfiny (należy monitorować oddychanie; często
występują nudności i może być konieczne
zastosowanie leku przeciwwymiotnego; poleca
się stosowanie małych dawek, powtarzanych w razie potrzeby) [I/C]
5) azotanów, jeśli nie ma hipotensji [I/C]
6) antagonisty aldosteronu (spironolaktonu lub
eplerenonu), jeśli LVEF ≤40% [I/B]
7) rozważenie wczesnej rewaskularyzacji, jeśli
pacjent nie został jeszcze poddany leczeniu
rewaskularyzacyjnemu [I/C].
2. Należy rozważyć stosowanie:
1) leków inotropowych – dopaminy [IIa/C] lub
dobutaminy [IIa/C]; można rozważyć zastosowanie
lewosymendanu (lek o działaniu inotropowo
dodatnim i rozszerzającym naczynia) [IIb/C]
2) ultrafiltracji [IIa/B].
Wstrząs kardiogenny (IV klasa Killipa)
1. Zaleca się:
1) podawanie tlenu i mechaniczne wspomaganie
wentylacji, w zależności od wyników gazometrii
[I/C]
2) niezwłoczne wykonanie echokardiografii z badaniem doplerowskim w celu wykrycia mechanicznych powikłań zawału, oceny czynności
skurczowej i obciążenia serca [I/C]
3) przetransportowanie chorych z grupy dużego
ryzyka do ośrodka referencyjnego [I/C]
4) rozważenie wykonania pilnej rewaskularyzacji
(PCI lub pomostowania aortalno-wieńcowego
[CABG]) u kwalifikujących się chorych [I/B].
2. Należy rozważyć zastosowanie:
1) leczenia fibrynolitycznego, jeśli PCI lub CABG
nie są dostępne [IIa/C]
2) leku o dodatnim działaniu inotropowym i kurczącym
naczynia – dopaminy [IIa/C] lub dobutaminy
[IIa/C]; można rozważyć zastosowanie
noradrenaliny (preferowana względem dopaminy,
gdy ciśnienie krwi jest niskie) [IIb/B].
3. Można rozważyć zastosowanie:
1) kontrapulsacji wewnątrzaortalnej [IIb/B]
2) urządzenia wspomagającego czynność lewej
komory w celu podtrzymania krążenia u chorych w stanie wstrząsu opornego na leczenie [IIb/C].
3) cewnika Swana i Ganza w celu oceny hemodynamicznej [IIb/B].
Zalecenia dotyczące postępowania w migotaniu przedsionków
U chorych z migotaniem przedsionków, którego przyczyna została usunięta (np. niedokrwienie mięśnia sercowego), należy rozważyć leczenie przywracające rytm zatokowy [IIa/C].
Doraźna kontrola częstotliwości rytmu u chorych z migotaniem przedsionków
Zaleca się stosowanie:
1) dożylne β-blokera lub blokera kanału wapniowego
niebędącego pochodną dihydropirydyny
(np. diltiazemu lub werapamilu), jeśli nie ma
objawów przedmiotowych ostrej niewydolności
serca (blokery kanału wapniowego należy
stosować ostrożnie lub unikać ich stosowania u chorych z niewydolnością serca ze względu
na ich ujemne działanie inotropowe) [I/A]
2) amiodaronu lub glikozydu naparstnicy dożylnie w przypadku szybkiej czynności komór u chorych z ostrą niewydolnością serca lub hipotensją [I/B].
Kardiowersja
1. Zaleca się:
1) niezwłoczne wykonanie kardiowersji elektrycznej,
gdy nie można szybko uzyskać odpowiedniej
kontroli częstotliwości rytmu za pomocą
leków u chorych z migotaniem przedsionków i utrzymującym się niedokrwieniem mięśnia
sercowego, ciężkimi zaburzeniami hemodynamicznymi
lub niewydolnością serca [I/C]
2) zastosowanie amiodaronu dożylnie w celu przywrócenia
rytmu zatokowego u chorych w stanie
stabilnym z migotaniem przedsionków o niedawnym
początku i strukturalną chorobą serca [I/A].
2. Nie zaleca się stosowania digoksyny [III/A],
werapamilu [III/B], sotalolu [III/B], metoprololu
[III/B] i innych β-blokerów [III/C] w celu przywracania
rytmu zatokowego u chorych z migotaniem
przedsionków o niedawnym początku, ponieważ
są nieskuteczne (β-bloker i digoksyna mogą być
stosowane w celu kontroli częstotliwości rytmu).
Zalecenia dotyczące postępowania w komorowych zaburzeniach rytmu i zaburzeniach przewodzenia w ostrej fazie STEMI
1. Zaleca się wykonanie kardiowersji elektrycznej w przypadku trwałego częstoskurczu
komorowego [I/C].
2. Należy rozważyć:
1) w przypadku trwałego jednokształtnego częstoskurczu
komorowego opornego na kardiowersję
elektryczną lub nawracającego po kardiowersji
– zastosowanie amiodaronu dożylnie [IIa/C];
można też rozważyć zastosowanie dożylnie lidokainy
lub sotalolu [IIb/C]
2) przerwanie częstoskurczu komorowego
za pomocą stymulacji przezżylnej, jeśli częstoskurcz
jest oporny na kardiowersję lub często
nawraca pomimo stosowania leków antyarytmicznych
[IIa/C]
3) samą obserwację albo leczenie dożylne
β-blokerem, sotalolem lub amiodaronem w przypadku nawracających objawowych salw
nietrwałego częstoskurczu komorowego jednokształtnego
[IIa/C].
Uwaga: nie należy stosować leków wydłużających
odstęp QT, jeśli wyjściowo jest wydłużony; nie należy stosować sotalolu ani innych β-blokerów
dożylnie, jeśli LVEF jest mała.
Częstoskurcz komorowy wielokształtny
1. Zaleca się:
1) stosowanie dożylne β-blokera [I/B] i amiodaronu
[I/C]; można zastosować dożylnie lidokainę
[IIb/C]
2) pilne wykonanie koronarografii, jeśli nie można
wykluczyć niedokrwienia mięśnia sercowego
[I/C]
3) pilną ocenę i ewentualne skorygowanie zaburzeń
elektrolitowych oraz rozważenie podania
magnezu [I/C].
2. Należy rozważyć zastosowanie stymulacji
przezżylnej lub wlewu izoproterenolu [IIa/C].
Chorzy z bradykardią zatokową związaną z hipotensją, blokiem AV II stopnia (Mobitz II) lub III stopnia z bradykardią powodującą hipotensję lub niewydolność serca
Zaleca się:
1) stosowanie: dożylnie atropiny [I/C], a w razie
jej nieskuteczności – czasowej stymulacji [I/C]
2) pilne wykonanie koronarografii z perspektywą
rewaskularyzacji, jeśli wcześniej chory nie
został poddany leczeniu reperfuzyjnemu [I/C].
Postępowanie w arytmiach komorowych i ocena długoterminowego ryzyka nagłego zgonu
Zaleca się:
1) wykonanie specjalistycznego badania elektrofizjologicznego w celu oceny wskazań do wszczepienia
kardiowertera-defibrylatora w ramach
wtórnej prewencji nagłej śmierci sercowej u chorych z istotną dysfunkcją lewej komory, u których
występuje hemodynamicznie niestabilny
trwały częstoskurcz komorowy lub którzy przebyli
udaną resuscytację z powodu migotania
komór po ostrej fazie zawału serca [I/A]
2) ocenę ryzyka nagłego zgonu sercowego w celu
ustalenia wskazań do wszczepienia kardiowertera-
defibrylatora w ramach prewencji pierwotnej
poprzez ocenę LVEF (za pomocą echokardiografii)
co najmniej 40 dni po wystąpieniu
zawału serca u chorych z LVEF ≤40% [I/A].
Inne powikłania STEMI
Pewne cechy demograficzne i kliniczne (zaawansowany wiek, niewydolność serca w II–IV klasie Killipa, choroba trójnaczyniowa, zawał ściany przedniej, długi czas niedokrwienia i zmniejszony przepływ TIMI) zwiększają ryzyko powikłań. Jeśli te cechy występują u pacjenta, może być konieczne dokładniejsze monitorowanie jego stanu. Mechaniczne powikłania zawału serca mogą wystąpić nagle w ciągu pierwszych dni po STEMI; występują rzadziej w przypadku szybkiej i skutecznej reperfuzji. Wszystkie te stany zagrażają życiu, dlatego trzeba je niezwłocznie rozpoznawać i leczyć. Dzięki powtarzanemu badaniu podmiotowemu i przedmiotowemu (co najmniej 2 razy dziennie) można wykryć u chorego nowy szmer sercowy spowodowany niedomykalnością mitralną lub ubytkiem przegrody międzykomorowej, które należy niezwłocznie zweryfikować echokardiograficznie.
1. Ostra niedomykalność zastawki mitralnej:
leczenie polega na zmniejszeniu obciążenia
następczego. Stosując dożylnie diuretyki, leki rozszerzające
naczynia i leki działające inotropowo
dodatnio oraz kontrapulsację wewnątrzaortalną,
można ustabilizować stan chorego do czasu wykonania
angiografii i operacji.
2. Pęknięcie wolnej ściany serca
3. Pęknięcie przegrody międzykomorowej:
zastosowanie kontrapulsacji wewnątrzaortalnej
może ustabilizować stan chorego do czasu wykonania
angiografii i operacji. W przypadku hipotensji
należy ostrożnie stosować dożylnie diuretyki i leki
rozszerzające naczynia. Konieczne jest pilne leczenie
operacyjne, ale nie ma zgodności co do tego,
kiedy najlepiej operację przeprowadzić.
4. Zawał prawej komory: może być izolowany,
ale częściej towarzyszy zawałowi ściany dolnej.
Mimo poszerzenia żył szyjnych należy przetaczać
płyny w celu utrzymania ciśnienia napełniania
prawej komory. Nie powinno się stosować diuretyków i leków rozszerzających naczynia, gdyż
nasilają hipotensję. W razie migotania przedsionków
lub bloku przedsionkowo-komorowego należy
szybko zastosować odpowiednie leczenie.
5. Zapalenie osierdzia: należy wykluczyć
wysięk krwotoczny i tamponadę. Ból zazwyczaj się zmniejsza po zastosowaniu ASA w dużych dawkach,
paracetamolu i kolchicyny. Należy unikać
stosowania glikokortykosteroidów i długotrwałego
stosowania niesteroidowych leków przeciwzapalnych.
Perikardiocenteza jest rzadko potrzebna. W przypadku wysięku należy przerwać leczenie
przeciwkrzepliwe, jeśli nie jest bezwzględnie
wskazane.
6. Tętniak lewej komory: ACEI (lub ARB) i antagoniści aldosteronu zmniejszają nasilenie
procesu przebudowy w zawałach pełnościennych,
dlatego należy je zastosować wcześnie, po ustabilizowaniu
stanu hemodynamicznego.
7. Zakrzep w lewej komorze: obecnie spotykany
coraz rzadziej dzięki powszechnemu stosowaniu
leków przeciwkrzepliwych w STEMI i wczesnemu
leczeniu reperfuzyjnemu. Jeśli wystąpi,
zaleca się stosowanie antagonisty witaminy K
do 6 miesięcy, ale nie wiadomo, jakie mogą być
następstwa takiego postępowania w erze stosowania
stentów i podwójnej terapii przeciwpłytkowej.
Nie wiadomo, jaki jest optymalny czas potrójnego
leczenia przeciwkrzepliwego. Kontrolne badanie
obrazowe lewej komory po 3 miesiącach leczenia
może pomóc w odstawieniu antykoagulacji, jeśli
nie wykaże się w nim obecności zakrzepu.
KOMENTARZ
prof. dr hab. med. Andrzej Budaj
Klinika Kardiologii Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Skróty: ASA – kwas acetylosalicylowy, ESC – European Society of Cardiology, HNF – heparyna niefrakcjonowana, pPCI – pierwotna przezskórna interwencja wieńcowa, STEMI – zawał serca z uniesieniem odcinka ST
W nowych wytycznych ESC dotyczących zawału serca z uniesieniem odcinka ST (STEMI) znajduje się szereg nowości. W porównaniu z poprzednimi wytycznymi z 2008 roku zawierają one większą liczbę rekomendacji (157), w tym 61% klasy I, 24% klasy IIa, 8% klasy IIb i 7% klasy III. Jednak tylko 21% rekomendacji ma poziom wiarygodności danych A, 35% – B i aż 44% – C. Tak duża liczba zaleceń opartych na opiniach ekspertów, małych badaniach lub rejestrach wskazuje na potrzebę prowadzenia dalszych badań.
Duży nacisk położono w wytycznych na wczesne rozpoznanie zawału i skrócenie opóźnień leczenia. Momentem startowym jest pierwszy kontakt pacjenta z personelem medycznym. Niezbędne jest wykonanie i ocena EKG w ciągu 10 minut. Zwraca się uwagę na możliwość wystąpienia nietypowych objawów, zwłaszcza u kobiet, u chorych z cukrzycą i w starszym wieku. Leczenie pacjenta powinno się prowadzić w ośrodku ze stale dostępną pracownią hemodynamiczną. Wyznaczono granice opóźnień jako miarę jakości leczenia: czas gotowości pracowni hemodynamicznej maksymalnie w ciągu 60 minut od zawiadomienia, wykonanie pierwotnej przez skórnej interwenji wieńcowej (pPCI) w ciągu 90 minut (60 min u chorych z czasem od początku objawów <120 min i z rozległym zawałem), rozpoczęcie leczenia fibrynolitycznego w ciągu 30 minut (przy czym leczenie to należy podjąć, jeśli nie można wykonać pPCI w ciągu 120 min). Po raz pierwszy w sposób szczególny potraktowano chorych z rozległym zawałem i krótkim czasem od początku objawów, którzy – jak wynika m.in. z badania Pinto i wsp. – ponoszą potencjalnie największe szkody na skutek opóźnienia leczenia reperfuzyjnego.1 Wykonanie koronarografii i ewentualnej angioplastyki zaleca się u wszystkich chorych po leczeniu fibrynolitycznym (u stabilnych chorych po skutecznym leczeniu fibrynolitycznym w ciągu 3–24 h). U chorych po zatrzymaniu krążenia z podejrzeniem zawału serca także należy przeprowadzić koronarografię. Chorzy, którzy pomimo skutecznej reanimacji po zatrzymaniu krążenia nie odzyskali przytomności, mają wskazania do terapeutycznej hipotermii. Stosowanie kontrapulsacji aortalnej nie jest wskazane u chorych bez wstrząsu kardiogennego, natomiast jej zastosowanie we wstrząsie jest słabym zaleceniem (IIb/B), podobnie jak zastosowanie urządzeń wspomagających czynność lewej komory (IIb/C) i cewnika Swana i Ganza w celu oceny hemodynamicznej (klasa IIb/B). Obniżenie klasy rekomendacji dla kontrapulsacji aortalnej potwierdziły wyniki badania IABP SHOCK II ogłoszone równocześnie z wytycznymi na tegorocznym Kongresie ESC w Monachium.2 U chorych we wstrząsie, z niskim ciśnieniem tętniczym, wskazano na preferencyjne podawanie noradrenaliny względem dopaminy, ale siła tego zalecenia też jest słaba (IIb/B).3 W towarzyszącej STEMI niewydolności serca opornej na leczenie diuretyczne zaleca się stosowanie ultrafiltracji.
W wytycznych ESC zawarto nowe zalecenia dotyczące stentów oraz leków przeciwpłytkowych i przeciwkrzepliwych. U chorych bez przeciwwskazań do przedłużonego podwójnego leczenia przeciwpłytkowego preferuje się stenty uwalniające lek. Po PCI zaleca się stosowanie wraz z kwasem acetylosalicylowym (ASA) prasugrelu u chorych nieprzyjmujących wcześniej klopidogrelu, bez przebytego udaru/napadu przemijającego niedokrwienia mózgu (TIA) i w wieku <75 lat; tikagreloru u wszystkich chorych (bez przeciwwskazań), także u leczonych zachowawczo, a klopidogrelu tylko wtedy gdy prasugrel lub tikagrelor są niedostępne lub przeciwwskazane. Podwójne leczenie przeciwpłytkowe należy stosować, jak dotychczas zalecano, przez 12 miesięcy. Wskazano minimalne okresy leczenia: 1 miesiąc po wszczepieniu stentu metalowego i 6 miesięcy po wszczepieniu stentu uwalniającego lek. Inhibitory receptora GP IIb/IIIa zaleca się jako leczenie ratunkowe, jeśli w koronarografii występuje masywny zakrzep, wolny przepływ lub jego brak, bądź powikłanie zakrzepowe. Dopuszcza się rutynowe stosowanie tych leków z heparyną niefrakcjonowaną (HNF) w czasie pPCI, jeśli nie ma przeciwwskazań, jak również ich wcześniejsze podawanie chorym obciążonym dużym ryzykiem, których transportuje się do pracowni hemodynamicznej w celu wykonania pPCI. Oprócz abciksymabu dopuszcza się podawanie eptifibatydu z podwójną dawką nasycającą lub tirofibanu z dużą dawką nasycającą. Przed pPCI preferuje się biwalirudynę zamiast HNF z inhibitorem GP IIb/IIa, a enoksaparynę (dawka 0,5 mg/kg i.v.) zamiast HNF. Po raz pierwszy dopuszczono (zalecenie słabe IIb/B) podawanie nowego doustnego leku przeciwkrzepliwego rywaroksabanu wybranym chorym leczonym ASA i klopidogrelem, z małym ryzykiem krwawienia, proponując małą dawkę 2,5 mg 2 × dz., która była testowana w badaniu ATLAS ACS II TIMI 51.4 Zwraca się uwagę na konieczność zmniejszenia dawek leków u chorych w starszym wieku i z niewydolnością nerek.
W wytycznych zaleca się wykonanie badania echokardiograficznego u wszystkich chorych w ostrej fazie,
gdy rozpoznanie jest niepewne, a w późniejszym okresie
– w celu oceny wielkości zawału i funkcji serca. Tomografia
komputerowa nie jest wskazana do rutynowego stosowania w STEMI.
Według wytycznych chory po niepowikłanym zabiegu
reperfuzyjnym powinien przebywać w warunkach intensywnej
terapii przez minimum 24 godziny, a następnie
na monitorowanym łóżku terapii półintensywnej przez
24–48 godzin. Wczesny wypis ze szpitala (po ok. 72 h)
można rozważyć u wybranych chorych małego ryzyka,
jeśli została zaplanowana wczesna rehabilitacja.
Wszystkim chorym zaleca się udział w programie rehabilitacyjnym. Chorym palącym papierosy należy udzielić
odpowiedniej porady i zapewnić udział w programie
leczenia uzależnienia od tytoniu.
Świeżo ogłoszone wytyczne ESC dotyczące STEMI umożliwiają istotny postęp w leczeniu tej grupy chorych, pod warunkiem że będą precyzyjnie stosowane. W polskich realiach mamy wszelkie szanse na dobrą realizację leczenia inwazyjnego, natomiast wciąż niedostępne są leki (prasugrel, tikagrelor, biwalirudyna), które uzyskały najwyższe rekomendacje w wytycznych i dla których wykazano zmniejszenie śmiertelności w porównaniu z leczeniem standardowym.5-7
Ponad 140 pracowni hemodynamicznych w Polsce stanowi jeden z największych w Europie potencjałów leczenia chorych ze STEMI. Niestety średnie opóźnienie od pierwszego kontaktu medycznego do pPCI jest w Polsce znacznie większe, niż dopuszczają wytyczne. Nowe limity czasowe uwzględniające krótki czas od początku objawów i rozległość zawału jako wskazania do skrócenia opóźnienia do 60 minut stanowią trudne, ale jak sądzę, możliwe do spełnienia zadanie. W praktyce ważne jest, aby chorzy z podejrzeniem STEMI trafiali bezpośrednio do ośrodka z pracownią hemodynamiczną. Jeśli są wysyłani do takiego ośrodka z innego miejsca, to zarówno lekarze wysyłający, jak i przyjmujący, powinni skalkulować i uzgodnić realne opóźnienie pPCI. W tym celu zgodnie z wytycznymi należy się posługiwać protokołami i algorytmami postępowania, które powinno się wprowadzać i sprawdzać w konkretnych sieciach ośrodków na danym terenie. Należy liczyć czas opóźnienia, nie tylko wtedy gdy prowadzony jest specjalny rejestr, ale także dla potrzeb bieżącej praktyki. Obecnie w Polsce tylko <1% chorych ze STEMI otrzymuje leczenie fibrynolityczne, mimo że średnie opóźnienia pPCI przekraczają postulowane maksymalne wartości. Wydaje się, że w sytuacjach nieuniknionego opóźnienia lub braku zgody chorego na leczenie inwazyjne, jest w Polsce miejsce na leczenie fibrynolityczne. Leki swoiste dla fibryny, w tym podawane we wstrzyknięciach (tenekteplaza, reteplaza), powinny być dostępne na izbach przyjęć lub na oddziałach ratunkowych szpitali bardziej oddalonych od ośrodków kardiologii inwazyjnej.
W bieżącym numerze "Medycyny Praktycznej" przedstawiona jest także trzecia uniwersalna definicja zawału serca.8 Najnowsza wersja definicji zawału została ogłoszona równocześnie z wytycznymi dotyczącymi STEMI na Kongresie ESC w Monachium i nie jest cytowana w tych wytycznych. Wytyczne odnoszą się do wersji poprzedniej z 2007 roku. Definicja druga i trzecia nie różnią się zasadniczo. W kolejnych wersjach definicji przedstawiono klasyfikację typów zawału serca. Klasyfikacja ta nie znalazła jednak żadnego odzwierciedlenia w wytycznych ESC dotyczących STEMI, jak również w wytycznych dotyczących ostrych zespołów wieńcowych bez uniesienia odcinka ST z 2011 roku. Istotną trudność stanowi brak wyników badań określających wpływ leczenia na poszczególne typy zawału. Pojawił się postulat, aby w planowanych w przyszłości badaniach dotyczących ostrych zespołów wieńcowych uwzględniać jako punkty końcowe poszczególne typy zawału. W praktyce klinicznej, wobec szerokiego stosowania testów wysokiej czułości do oznaczania troponin, dużym wyzwaniem jest interpretacja wyników tych oznaczeń i decyzje dotyczące leczenia chorych z zawałem typu drugiego, spowodowanym inną przyczyną niż choroba wieńcowa, np. tachy- lub bradyarytmią, niedokrwistością, niewydolnością oddechową lub hipotensją. Te sytuacje wymagają indywidualnej oceny, zastanowienia się i dyskusji, gdyż w wytycznych brakuje odpowiednich rekomendacji postępowania.
Z jednej więc strony istnieje jednoznaczna potrzeba pełnego i dokładnego stosowania wytycznych, z drugiej zaś w wielu sytuacjach musimy polegać na rozumieniu mechanizmów patofizjologicznych i własnym doświadczeniu.
PIŚMIENNICTWO DO KOMENTARZA
1. Pinto D.S., Kirtane A.J., Nallamothu B.K. i wsp.: Hospital delays in reperfusion for ST
elevation myocardial infarction: implications when selecting a reperfusion strategy.
Circulation, 2006; 114: 2019–2025
2. Thiele H., Zeymer U., Neumann H.J. i wsp.; IABP SHOCK II Trial Investigators: Intraaortic
Balloon Support for Myocardial Infarction with Cardiogenic Shock. N. Engl. J. Med., 2012;
(publ. elektron. przed drukiem)
3. De Backer D., Biston P., Devriendt J. i wsp.: Comparison of dopamine and norepinephrine
in the treatment of shock. N. Engl. J. Med., 2010; 362: 779–789
4. Mega J.L., Braunwald E., Wiviott S.D. i wsp.: Rivaroxaban in patients with a Recent Acute
Coronary Syndrome. N. Engl. J. Med., 2012; 366: 9–19
5. Montalescot G., Wiviott S.D., Braunwald E. i wsp.: Prasugrel compared with clopidogrel
in patients undergoing percutaneous coronary intervention for ST-elevation myocardial
infarction (TRITON-TIMI 38): double-blind, randomized controlled trial. Lancet, 2009;
373: 723–731
6. Wallentin L., Becker R.C., Budaj A. i wsp.: Ticagrelor versus clopidogrel in patients with
acute coronary syndromes. N. Engl. J. Med., 2009; 361: 1045–1057
7. Stone G.W., Witzenbichler B., Gaugliumi G. i wsp.: Bivalirudin during primary PCI in
acute myocardial infarction. N. Engl. J. Med., 2008; 358: 2218–2230
8. Thygesen K., Alpert J.S., Jaffe A.S. i wsp.: Joint ESC/ACCF/AHA/WHF Task Force for
the Universal Definition of Myocardial Infarction: third universal definition of myocardial
infarction. Eur. Heart J., 2012 (publ. elektron. przed drukiem)









