Tabela 4. Klasyfikacja Killipa i Kimballa
| Stadium | Cechy |
| I – nie ma niewydolności serca | nie ma objawów klinicznych dekompensacji serca (zastoju w krążeniu płucnym, III tonu) |
| II – niewydolność serca | zastój krwi w płucach objawiający się wilgotnymi
rzężeniami na obszarze mniejszym niż dolna połowa pól płucnych lub III ton serca |
| III – ciężka niewydolność serca | pełnoobjawowy obrzęk płuc lub rzężenia nad obszarem
większym niż połowa pól płucnych |
| IV – wstrząs kardiogenny | hipotensja (ciśnienie tętnicze skurczowe ≤90 mm Hg) oraz
cechy hipoperfuzji obwodowej: skąpomocz, sinica i obfite pocenie się |
Zalecenia dotyczące badań diagnostycznych u chorych
ambulatoryjnych z podejrzeniem NS
Poniższe zalecenia nie obejmują wszystkich
badań diagnostycznych, które mogą być wskazane u chorych z podejrzeniem NS, zwłaszcza
ostrej w warunkach oddziału pomocy doraźnej
lub oddziału szpitalnego (np. oznaczenie troponiny
sercowej lub dimeru D we krwi, cewnikowanie
prawej części serca).
Wszyscy chorzy
1. Zaleca się wykonanie:
1) echokardiografii przezklatkowej – w celu
oceny budowy i czynności serca, w tym czynności
rozkurczowej, oraz pomiaru LVEF dla rozpoznania
NS, ułatwienia planowania i monitorowania
leczenia, a także uzyskania informacji o znaczeniu rokowniczym [I/C]
2) EKG 12-odprowadzeniowego – w celu oceny
rytmu serca, częstotliwości rytmu, morfologii
zespołów QRS i czasu ich trwania oraz wykrycia
innych nieprawidłowości (p. niżej) [I/C]; uzyskane
informacje mogą być również pomocne w planowaniu leczenia i mieć znaczenie rokownicze. W przypadku całkowicie prawidłowego
EKG skurczowa NS jest mało prawdopodobna.
3) badań biochemicznych krwi (w tym stężeń:
sodu, potasu, wapnia, mocznika, kreatyniny
[z oszacowaniem przesączania kłębuszkowego],
bilirubiny, ferrytyny [i/lub całkowitej zdolności
wiązania żelaza] oraz aktywności enzymów
wątrobowych) oraz parametrów czynności
tarczycy [I/C] – w celu ustalenia wskazań
do leczenia lekami moczopędnymi, antagonistami
układu renina-angiotensyna-aldosteron i lekami przeciwzakrzepowymi (oraz monitorowania
terapii), wykrycia odwracalnej/uleczalnej
przyczyny NS (np. hipokalcemia, dysfunkcja
tarczycy) i chorób współistniejących (np. niedobór
żelaza) oraz uzyskania informacji o znaczeniu
rokowniczym
4) badania pełnej morfologii krwi [I/C] – w celu wykrycia niedokrwistości (która może
być przyczyną objawów podmiotowych i przedmiotowych
występujących u chorego, a także
może nasilać NS) oraz uzyskania informacji o znaczeniu rokowniczym.
2. Należy rozważyć wykonanie:
1) oznaczenia stężenia peptydu natriuretycznego
(peptyd natriuretyczny typu B [BNP],
N-końcowy propeptyd natriuretyczny typu B
[NT-proBNP], środkowa część przedsionkowego
propeptydu natriuretycznego [MR-proANP])
[IIa/C] – w celu wykluczenia innych przyczyn
duszności (jeśli stężenie jest mniejsze od progu
wykluczenia, NS jest bardzo mało prawdopodobna)
oraz uzyskania informacji o znaczeniu
rokowniczym. Proponowane wartości decyzyjne w diagnostyce przewlekłej NS:
– BNP <35 pg/ml, NT-proBNP <125 pg/ml i prawidłowy EKG – NS mało prawdopodobna
– BNP ≥125 pg/ml, NT-proBNP ≥125 pg/ml
– należy wykonać badanie echokardiograficzne.
Proponowane wartości decyzyjne w diagnostyce
NS u chorych z ostrą dusznością:
– BNP <100 pg/ml, NT-proBNP <300 pg/ml,
MR-proANP <120 pmol/l – NS mało prawdopodobna
– BNP ≥100 pg/ml, NT-proBNP ≥300 pg/ml
– należy wykonać badanie echokardiograficzne.
2) radiogramu (RTG) klatki piersiowej – w celu wykrycia lub wykluczenia pewnych chorób
płuc (np. raka; RTG nie wyklucza astmy i POChP) [IIa/C]; może również uwidocznić
zastój w płucach i obrzęk płuc; może być bardziej
przydatny u chorych z podejrzeniem NS i ostrymi objawami.
Wybrani chorzy
1. Zaleca się wykonanie:
1) rezonansu magnetycznego serca (cardiac
magnetic resonance – CMR) – w celu oceny
budowy i czynności serca, pomiaru LVEF i oceny tkanki sercowej, zwłaszcza u chorych, u których rozpoznanie na podstawie badania
echokardiograficznego nie jest możliwe (nie
można uzyskać dobrego obrazu lub obraz nie
jest jednoznaczny; należy pamiętać o środkach
ostrożności i przeciwwskazaniach do CMR)
[I/C]
2) koronarografii u chorych z dławicą piersiową,
którzy kwalifikowaliby się do rewaskularyzacji
wieńcowej – w celu oceny anatomii tętnic wieńcowych
[I/C]
3) cewnikowania lewej i prawej części serca u chorych kwalifikowanych do przeszczepienia
serca lub mechanicznego wspomagania krążenia
– w celu oceny czynności prawej i lewej
części serca oraz oporu tętnic płucnych [I/C].
2. Należy rozważyć wykonanie:
1) badania obrazowego perfuzji/niedokrwienia
mięśnia sercowego (echokardiografia,
CMR, tomografia emisyjna pojedynczego
fotonu [SPECT] lub pozytonowa tomografia
emisyjna [PET]) u chorych z podejrzeniem
choroby wieńcowej, którzy kwalifikowaliby się
do rewaskularyzacji – w celu oceny występowania
odwracalnego niedokrwienia mięśnia sercowego i obszaru żywotnego mięśnia sercowego
[IIa/C]
2) próby wysiłkowej – w celu wykrycia odwracalnego
niedokrwienia mięśnia sercowego, w ramach kwalifikacji do przeszczepienia
serca i mechanicznego wspomagania krążenia, w ramach kwalifikacji do programu ćwiczeń
fizycznych oraz w celu uzyskania informacji o znaczeniu rokowniczym [IIa/C].
Nieprawidłowości stwierdzane w badaniach pomocniczych u chorych z niewydolnością serca
1. Nieprawidłowości w EKG najczęściej
stwierdzane u chorych z NS (po pauzie podane
możliwe przyczyny):
1) tachykardia zatokowa – dekompensacja NS,
niedokrwistość, gorączka, nadczynność tarczycy
2) bradykardia zatokowa – leki (β-blokery, digoksyna,
iwabradyna, werapamil, diltiazem,
leki antyarytmiczne), niedoczynność tarczycy,
zespół chorego węzła zatokowego
3) tachykardia przedsionkowa, trzepotanie lub
migotanie przedsionków (atrial fibrillation –
AF) – nadczynność tarczycy, zakażenie, choroba
zastawki mitralnej, dekompensacja NS,
zawał serca
4) arytmie komorowe – niedokrwienie mięśnia
sercowego, zawał serca, kardiomiopatia, zapalenie
mięśnia sercowego, hipokaliemia, hipomagnezemia,
przedawkowanie glikozydu naparstnicy
5) cechy niedokrwienia lub zawału mięśnia sercowego
– choroba wieńcowa
6) załamki Q – zawał serca, kardiomiopatia przerostowa,
blok lewej odnogi pęczka Hisa (left
bundle branch block – LBBB), zespoły preekscytacji
7) przerost lewej komory – nadciśnienie tętnicze,
choroba zastawki aortalnej, kardiomiopatia
przerostowa
8) blok przedsionkowo-komorowy (AV) – zawał
serca, toksyczność leków, zapalenie mięśnia
sercowego, sarkoidoza, kardiomiopatia uwarunkowana
genetycznie (laminopatia, desminopatia),
borelioza z Lyme
9) niski woltaż zespołu QRS – otyłość, rozedma
płuc, płyn w worku osierdziowym, skrobiawica
10) czas trwania zespołu QRS ≥120 ms i morfologia
odpowiadająca LBBB – dyssynchronia elektryczna i mechaniczna.
2. Nieprawidłowości w wynikach badań
laboratoryjnych często stwierdzane u chorych z NS (po pauzie podane możliwe przyczyny):
1) upośledzenie czynności nerek (kreatynina >150 µmol/l [1,7 mg/dl], eGFR
<60 ml/min/1,73 m2) – choroba nerek, zastój
krwi w nerkach, przyjmowanie inhibitorów
konwertazy angiotensyny (ACEI)/blokerów
receptora angiotensynowego (ARB)/antagonistów
receptora mineralokortykoidowego
(MRA), odwodnienie, stosowanie niesteroidowych
leków przeciwzapalnych (NSLPZ) lub
innych leków nefrotoksycznych
2) niedokrwistość (hemoglobina <13 g/dl
[8 mmol/l] u mężczyzn, <12 g/dl [7,4 mmol/l] u kobiet) – przewlekła NS, rozcieńczenie krwi,
utrata żelaza lub upośledzona utylizacja, niewydolność
nerek, choroba przewlekła, choroba
nowotworowa
3) hiponatremia (<135 mmol/l) – przewlekła NS,
rozcieńczenie krwi, uwalnianie wazopresyny,
przyjmowanie diuretyków (zwłaszcza tiazydowych) i innych leków
4) hipernatremia (>150 mmol/l) – odwodnienie
lub zbyt mała podaż płynów
5) hipokaliemia (<3,5 mmol/l) – przyjmowanie
diuretyków, wtórny hiperaldosteronizm
6) hiperkaliemia (>5,5 mmol/l) – niewydolność
nerek, przyjmowanie suplementów potasu,
przyjmowanie leków blokujących układ renina-angiotensyna-aldosteron
7) hiperglikemia (>6,5 mmol/l [117 mg/dl]) –
cukrzyca, oporność na insulinę
8) hiperurykemia (>500 µmol/l [8,4 mg/dl]) –
leczenie moczopędne, dna, choroba nowotworowa
9) zwiększone stężenie albuminy (>45 g/l) – odwodnienie, szpiczak
10) zmniejszone stężenie albuminy (<30 g/l) – niedożywienie,
utrata przez nerki
11) zwiększona aktywność aminotransferaz – dysfunkcja
lub przekrwienie wątroby, toksyczność leków
12) zwiększone stężenie troponin sercowych – martwica kardiomiocytów, przedłużające się
niedokrwienie mięśnia sercowego, ciężka NS, zapalenie mięśnia sercowego, sepsa, niewydolność
nerek
13) zwiększona aktywność kinazy kreatynowej – wrodzone lub nabyte miopatie (w tym zapalenie
mięśni)
14) nieprawidłowe wyniki badań czynności tarczycy – nadczynność lub niedoczynność, przyjmowanie
amiodaronu
15) nieprawidłowości w badaniu moczu – białkomocz, glukozuria, obecność bakterii
16) INR >3,5 – przedawkowanie leków przeciwkrzepliwych,
choroba lub przekrwienie
wątroby, interakcje lekowe
17) CRP >10 mg/l, leukocytoza neutrofilowa –
zakażenie, zapalenie.
3. Nieprawidłowości w echokardiografii
często stwierdzane u chorych z NS (po pauzie
podane możliwe przyczyny):
1) zmniejszona LVEF (<50%) – zaburzenie globalnej
czynności skurczowej lewej komory
2) zmniejszona frakcja skracania wymiaru lewej
komory (<25%) – dysfunkcja skurczowa lewej
komory
3) odcinkowa hipokineza, akineza lub dyskineza
lewej komory – niedokrwienie lub zawał mięśnia
sercowego, kardiomiopatia, zapalenie
mięśnia sercowego
4) zwiększenie końcoworozkurczowego wymiaru
(≥60 mm, >32 mm/m2) i objętości (>97 ml/m2)
lewej komory – prawdopodobne przeciążenie
objętościowe
5) zwiększenie końcowoskurczowego wymiaru
(>45 mm/>25 mm/m2) i objętości (>43 ml/m2)
lewej komory – prawdopodobne przeciążenie
objętościowe
6) zmniejszona całka prędkości przepływu w czasie w drodze odpływu lewej komory (LV
out flow tract velocity time integral) (<15 cm)
– zmniejszona objętość wyrzutowa lewej
komory
7) nieprawidłowości parametrów świadczących o dysfunkcji rozkurczowej lewej komory (przepływu
mitralnego, prędkość wczesnorozkurczowa
pierścienia mitralnego [E'] lub stosunek
prędkości maksymalnej wczesnego napływu
mitralnego [E] do E') – wskazują na stopień
dysfunkcji rozkurczowej lewej komory oraz
przybliżoną wartość ciśnienia napełniania
8) zwiększony wskaźnik objętości lewego przedsionka
(>34 ml/m2) – zwiększone (w ostatnim czasie lub obecnie) ciśnienie napełniania lewej
komory, choroba zastawki mitralnej
9) zwiększony wskaźnik masy lewej komory
(>95 g/m2 u kobiet i >115 g/m2 u mężczyzn)
– nadciśnienie tętnicze, zwężenie zastawki
aortalnej, kardiomiopatia przerostowa
10) zwężenie lub niedomykalność zastawki
(zwłaszcza stenoza aortalna i niedomykalność
zastawki mitralnej) – może być przyczyną NS,
czynnikiem wikłającym lub następstwem NS
(wtórna niedomykalność mitralna)
11) nieprawidłowe parametry czynności prawej
komory (np. zmniejszona amplituda ruchu pierścienia
zastawki trójdzielnej [TAPSE] <16 mm)
– dysfunkcja skurczowa prawej komory
12) zwiększona maksymalna prędkość fali zwrotnej
przez zastawkę trójdzielną (>3,4 m/s)
– zwiększone ciśnienie skurczowe w prawej
komorze
13) zwiększone ciśnienie skurczowe w tętnicy
płucnej (>50 mm Hg) – prawdopodobne nadciśnienie
płucne
14) poszerzona żyła główna dolna niezapadająca
się w cyklu oddechowym – zwiększone ciśnienie w prawym przedsionku, dysfunkcja prawej
komory, przeciążenie objętościowe, możliwe
nadciśnienie płucne
15) wysięk lub krew w worku osierdziowym, zwapnienia
osierdzia – tamponada serca, choroba
nowotworowa, choroba układowa, ostre lub
przewlekłe zapalenie osierdzia, zaciskające
zapalenie osierdzia.
4. Echokardiograficzne cechy dysfunkcji
rozkurczowej lewej komory często stwierdzane u chorych z NS (po pauzie podane znaczenie
kliniczne):
1) zmniejszenie predkości wczesnorozkurczowej
pierścienia mitralnego (E') <9 cm/s – upośledzona
relaksacja lewej komory
2) E/E'
a) >15 – wysokie ciśnienie napełniania lewej
komory
b) <8 – prawidłowe ciśnienie napełniania
c) wartości pośrednie – potrzebna jest ocena
dodatkowych parametrów
3) stosunek prędkości fali wczesnego napływu
mitralnego do predkości napływu mitralnego w czasie skurczu przedsionka (E/A)
a) >2 – restrykcja, wysokie ciśnienie napełniania
lewej komory, przeciążenie objętościowe
b) <1 – upośledzona relaksacja, prawidłowe
ciśnienie napełniania lewej komory
c) 1–2 – norma lub pseudonormalizacja
4) zmiana napływu mitralnego w czasie próby
Valsalvy – zmniejszenie E/A z wartości pseudonormalnych
(p. wyżej) do ≥0,5 świadczących o restrykcji
5) różnica czasu trwania przepływu wstecznego
krwi do żyły płucnej w czasie skurczu przedsionka i napływu mitralnego w czasie skurczu
przedsionka >30 ms – wysokie ciśnienie napełniania
lewej komory.
Leczenie farmakologiczne niewydolności serca ze zmniejszoną frakcją wyrzutową
(skurczowej niewydolności serca)
1. Algorytm leczenia przewlekłej objawowej
(NYHA II–IV) skurczowej NS – p. rycina 1.
2. Dawkowanie często stosowanych diuretyków
przedstawiono w tabeli 5, a dawkowanie leków
modyfikujących przebieg choroby, czyli ACEI,
β-blokerów, ARB i MRA – w tabeli 6.
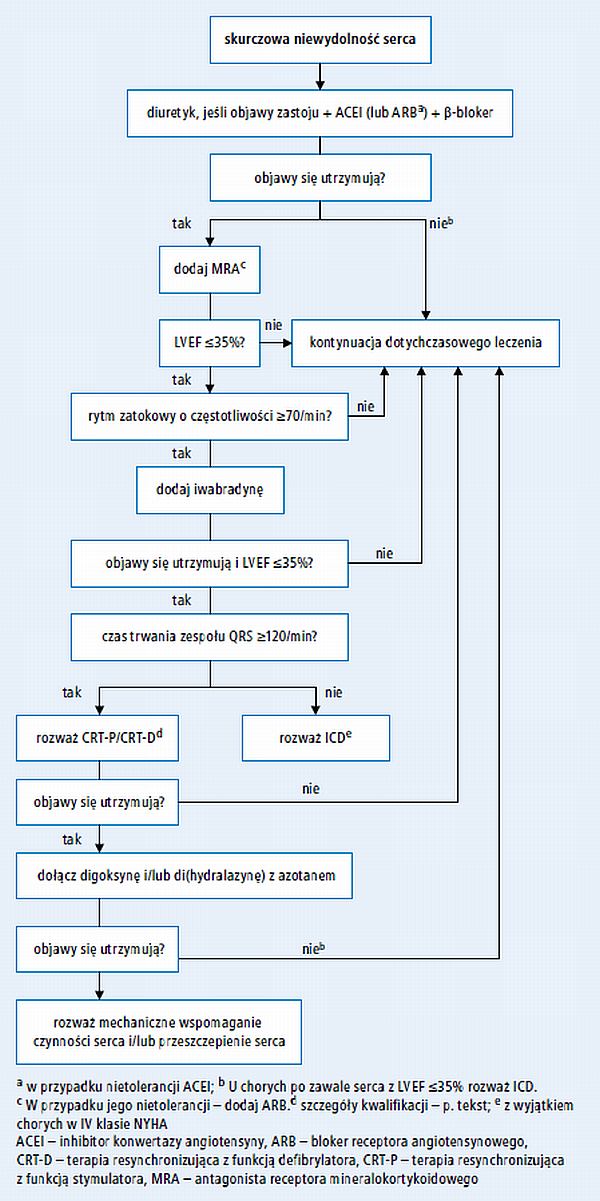
Ryc. 1. Postępowanie w przewlekłej skurczowej niewydolności serca (na podstawie
wytycznych ESC 2012, zmodyfikowane)
Tabela 5. Dawkowanie diuretyków w przewlekłej niewydolności serca
| Lek | Dawka początkowa (mg/d) | Typowa dawka (mg/d) |
| diuretyki pętlowe |
| furosemid | 20–40 | 40–240 |
| bumetanid | 0,5–1,0 | 1–5 |
| torasemid | 5–10 | 10–20 |
| diuretyki tiazydowe i tiazydopodobne |
| bendroflumetiazyd | 2,5 | 2,5–10 |
| hydrochlorotiazyd | 25 | 12,5–100 |
| metolazon | 2,5 | 2,5–10 |
| indapamid | 2,5 | 2,5–5,0 |
| diuretyk oszczędzający potasa |
| amiloryd | 2,5 (5) | 5–10 (10–20) |
| eplerenon | 12,5–25 (50) | 50 (100–200) |
| spironolakton | 12,5–25 (50) | 50 (100–200) |
| triamteren | 25 (50) | 100 (200) |
| a w nawiasach dawki u chorych nieprzyjmujących ACEI i ARB |
3. Jeśli stosuje się lek moczopędny powodujący
utratę potasu w skojarzeniu z ACEI i MRA (lub
ARB), to zwykle nie ma potrzeby suplementacji
potasu. U chorych przyjmujących diuretyki oszczędzające
potas lub suplementy potasu w skojarzeniu z ACEI (lub ARB) i MRA może wystąpić ciężka
hiperkaliemia.
Zalecenia dotyczące leczenia
farmakologicznego chorych z objawową
skurczową NS (NYHA II–IV)
1. Zaleca się stosowanie:
1) ACEI jako dodatku do β-blokera u wszystkich
chorych z LVEF ≤40% – w celu zmniejszenia
ryzyka hospitalizacji i przedwczesnej śmierci z powodu NS [I/A]
2) β-blokera jako dodatku do ACEI (lub ARB,
jeśli ACEI nie są tolerowane) u wszystkich
chorych z LVEF ≤40% – w celu zmniejszenia
ryzyka hospitalizacji i przedwczesnego zgonu z powodu NS [I/A]
3) MRA u wszystkich chorych z utrzymującymi
się objawami (NYHA II–IV) i LVEF ≤35%
pomimo leczenia ACEI (lub ARB, jeśli ACEI
nie są tolerowane) i β-blokerem – w celu zmniejszenia
ryzyka hospitalizacji i przedwczesnej
śmierci z powodu NS [I/A]
4) ARB – w celu
a) zmniejszenia ryzyka hospitalizacji i przedwczesnej
śmierci z powodu NS u chorych z LVEF ≤40% niemogących przyjmować
ACEI z powodu kaszlu (chorzy ci powinni
również otrzymywać β-bloker i MRA) [I/A]
b) zmniejszenia ryzyka hospitalizacji u chorych z LVEF ≤40% i utrzymującymi się
objawami (NYHA II–IV) pomimo leczenia
ACEI i β-blokerem, którzy nie tolerują MRA
[I/A].
2. Należy rozważyć stosowanie iwabradyny w celu zmniejszenia ryzyka hospitalizacji u chorych z rytmem zatokowym i LVEF ≤35%, częstotliwością
rytmu serca utrzymującą się ≥70/min i nieustępującymi objawami (NYHA II–IV)
pomimo leczenia β-blokerem w zalecanych dawkach
(lub maksymalnych tolerowanych) oraz ACEI
(lub ARB) i MRA (lub ARB) [IIa/B] (Europejska
Agencja Leków zatwierdziła stosowanie iwabradyny u chorych z częstotliwością rytmu serca ≥75/
min). Stosowanie iwabradyny można rozważyć w celu zmniejszenia ryzyka hospitalizacji z powodu
NS u chorych z rytmem zatokowym, LVEF ≤35% i częstotliwością rytmu serca ≥70/min, którzy nie
mogą przyjmować β-blokera; tacy chorzy powinni
przyjmować ACEI (lub ARB) i MRA (lub ARB)
[IIb/C].
3. Można rozważyć stosowanie:
1) digoksyny – w celu
a) zmniejszenia ryzyka hospitalizacji z powodu
NS u chorych z rytmem zatokowym i LVEF
≤45%, którzy nie mogą przyjmować β-blokera
(chorzy z częstotliwością rytmu serca ≥70/min
mogą zamiast β-blokera przyjmować iwabradynę);
tacy chorzy powinni przyjmować ACEI
(lub ARB) i MRA (lub ARB) [IIb/B]
b) zmniejszenia ryzyka hospitalizacji u chorych z LVEF ≤45% i utrzymującymi się objawami
(NYHA II–IV) pomimo leczenia β-blokerem,
ACEI (lub ARB) i MRA (lub ARB) [IIb/B]
2) hydralazyny z diazotanem izosorbidu
a) jako alternatywę dla ACEI lub ARB, jeśli
leki z obu tych grup nie są tolerowane – w celu zmniejszenia ryzyka hospitalizacji i przedwczesnej śmierci z powodu NS u chorych z LVEF ≤45% i poszerzoną lewą komorą
(lub LVEF ≤35%); chorzy ci powinni również
przyjmować β-bloker i MRA [IIb/B]
b) w celu zmniejszenia ryzyka hospitalizacji i przedwczesnej śmierci z powodu NS u chorych z LVEF ≤45% i poszerzoną lewą
komorą (lub LVEF ≤35%) i utrzymującymi
się objawami (NYHA II–IV) pomimo leczenia
β-blokerem, ACEI (lub ARB) i MRA (lub
ARB) [IIb/B]
3) preparatu wielonienasyconych kwasów
tłuszczowych n-3 (PUFA) – w celu zmniejszenia
ryzyka zgonu i hospitalizacji z przyczyn
sercowo-naczyniowych u chorych leczonych
ACEI (lub ARB), β-blokerem i MRA (lub ARB)
[IIb/B].
4. Nie powinno się stosować:
1) pochodnych tiazolidynodionu (glitazonu), gdyż
mogą one spowodować pogorszenie NS i zwiększyć
ryzyko hospitalizacji z powodu NS [III/A]
2) większości blokerów kanału wapniowego
(z wyjątkiem amlodypiny i felodypiny), ponieważ
wykazują ujemne działanie inotropowe i mogą spowodować pogorszenie NS [III/B]
3) NSLPZ i inhibitorów COX-2, gdyż mogą spowodować
zatrzymywanie sodu i wody, pogorszenie
czynności nerek i nasilenie NS [III/B]
4) ARB lub inhibitora reniny w połączeniu z ACEI i MRA, ponieważ mogą spowodować dysfunkcję
nerek i hiperkaliemię [III/C].
Leczenie farmakologiczne
niewydolności serca z zachowaną
frakcją wyrzutową (rozkurczowej
niewydolności serca)
1. Nie ma przekonujących dowodów na to,
że którykolwiek ze stosowanych leków zmniejsza
chorobowość i umieralność u chorych z NS z zachowaną
LVEF.
2. Diuretyki stosowane w celu opanowania
retencji sodu i wody zmniejszają duszność i obrzęki podobnie jak u chorych z NS ze zmniejszoną
LVEF.
3. Uważa się za ważne odpowiednie leczenie
nadciśnienia tętniczego i niedokrwienia mięśnia
sercowego, jak również kontrolę częstotliwości
rytmu komór u chorych z AF.
4. W 2 bardzo małych badaniach wykazano,
że bloker kanału wapniowego zwalniający czynność
serca (werapamil) może poprawić wydolność
czynnościową i zmniejszyć objawy podmiotowe u takich chorych. Blokery kanału wapniowego
zwalniające czynność serca mogą być również
przydatne do kontroli częstotliwości rytmu komór u chorych z AF oraz w leczeniu nadciśnienia tętniczego i niedokrwienia mięśnia sercowego (w przeciwieństwie
do chorych z niewydolnością serca
ze zmniejszoną frakcją wyrzutową, u których
stosowanie leków o działaniu inotropowoujemnym
może być niebezpieczne). Do kontroli częstotliwości
rytmu komór u chorych z AF i NS z zachowaną
frakcją wyrzutową mogą być również przydatne
β-blokery.
5. U chorych z NS z zachowaną LVEF powinno
się unikać stosowania tych samych leków, co u chorych z NS ze zmniejszoną LVEF (p. wyżej), z wyjątkiem blokerów kanału wapniowego.
Ogólne zasady stosowania
ACEI/ARB, MRA, β-blokerów i diuretyków
1. ACEI, ARB, MRA i β-blokery stosuje się w NS w celu:
1) poprawy w zakresie objawów podmiotowych
oraz wydolności wysiłkowej
2) zmniejszenia ryzyka hospitalizacji z powodu
NS
3) zwiększenia przeżywalności.
2. Diuretyki stosuje się w NS w celu zniesienia
duszności i obrzęków u chorych z przewodnieniem.
3. Uchwytna poprawa w zakresie objawów podmiotowych i przedmiotowych NS po zastosowaniu
ACEI, ARB, MRA i β-blokerów występuje zwykle
po kilku tygodniach lub później (nawet po kilku
miesiącach).
4. Pacjentów należy poinformować:
1) o spodziewanych korzyściach z zastosowanego
leczenia
2) kiedy może wystąpić poprawa w zakresie objawów
podmiotowych i przedmiotowych NS, aby
– nie widząc szybkiego efektu – nie zaprzestali
przyjmowania leków (dotyczy to ACEI, ARB,
MRA i β-blokerów)
3) o możliwych interakcjach lekowych (zwłaszcza z lekami dostępnymi bez recepty, głównie
NSLPZ) i działaniach niepożądanych przyjmowanych
leków
4) o konieczności niezwłocznego zgłoszenia się
do lekarza w razie wystąpienia objawów świadczących o nasileniu NS. W celu wczesnego
wykrycia zaostrzenia pacjent powinien codziennie
się ważyć (po wstaniu z łóżka, przed ubraniem
się, po mikcji, a przed posiłkiem) i zwiększyć
dawkę diuretyku, jeśli przyrost masy ciała o >1,5–2 kg utrzymuje się przez >2 dni.
ACEI i ARB w skurczowej niewydolności serca
1. Wskazania:
1) potencjalnie wszyscy chorzy z NS i LVEF ≤40%
2) leki pierwszego rzutu (w skojarzeniu z β-blokerem i MRA) u chorych w II–IV klasie
NYHA; należy rozpocząć ich stosowanie
możliwie jak najwcześniej w przebiegu choroby
3) ACEI są również korzystne u chorych z bezobjawową
dysfunkcją skurczową lewej komory (NYHA I).
2. Przeciwwskazania:
1) obrzęk naczynioruchowy w wywiadzie
2) rozpoznane obustronne zwężenie tętnicy nerkowej
3) ciąża lub możliwość zajścia w ciążę.
3. Należy zachować ostrożność w sytuacji:
1) hiperkaliemii (K+ >5,0 mmol/l)
2) istotnej dysfunkcji nerek (kreatyninemia >221 µmol/l [2,5 mg/dl] lub eGFR
<30 ml/min/1,73 m2)
3) objawowej lub ciężkiej bezobjawowej hipotensji
(ciśnienie tętnicze skurczowe <90 mm Hg).
4. Należy zwracać uwagę na interakcje
lekowe z:
1) suplementami potasu, diuretykami oszczędzającymi
potas (np. amilorydem i triamterenem), MRA i inhibitorami reniny
2) NSLPZ
3) trimetoprimem i kotrimoksazolem
4) substytutami ubogosolnymi o dużej zawartości potasu.
5. Dawkowanie i monitorowanie
1) sprawdzić czynność nerek i stężenia elektrolitów
we krwi
2) rozpocząć od małej dawki (tab. 6)
3) podwajać dawkę nie częściej niż co 2 tygodnie
(można szybciej u chorych hospitalizowanych
lub ściśle monitorowanych, jeśli lek jest dobrze
tolerowany)
4) dążyć do osiągnięcia dawki docelowej (tab. 6)
lub największej tolerowanej
5) wykonać kontrolne badania biochemiczne
krwi (mocznik, kreatynina, potas) 1–2 tygodni
po rozpoczęciu leczenia i 1–2 tygodni po osiągnięciu
dawki docelowej/maksymalnej tolerowanej,
następnie co 4 miesiące.
Tabela 6. Dawkowanie leków w przewlekłej
niewydolności serca
| Lek | Dawka |
| początkowa | docelowa |
| ACEI |
| enalapryl | 2,5 mg 2 × dz. | 10–20 mg 2 × dz. |
| kaptopryl | 6,25 mg 3 × dz. | 50 mg 3 × dz. |
| lizynopryl | 2,5–5,0 mg 1 × dz. | 20–35 mg 1 × dz. |
| ramipryl | 2,5 mg 1 × dz. | 5 mg 2 × dz. |
| trandolapryl | 0,5 mg 1 × dz. | 4 mg 1 × dz. |
| β-blokery |
| bisoprolol | 1,25 mg 1 × dz. | 10 mg 1 × dz. |
| metoprolola | 12,5–25 mg 1 × dz. | 200 mg 1 × dz. |
| karwedilol | 3,125 mg 2 × dz. | 25–50 mg 2 × dz. |
| nebiwololb | 1,25 mg 1 × dz. | 10 mg 1 × dz. |
| ARB |
| kandesartan | 4–8 mg 1 × dz. | 32 mg 1 × dz. |
| walsartan | 40 mg 2 × dz. | 160 mg 2 × dz. |
| losartanb | 50 mg 1 × dz. | 150 mg 1 × dz. |
| MRA |
| eplerenon | 25 mg 1 × dz. | 50 mg 1 × dz. |
| spironolakton | 25 mg 1 × dz. | 25–50 mg 1 × dz. |
a bursztynian metoprololu o przedłużonym uwalnianiu
b lek, który nie powodował zmniejszenia śmiertelności w badaniach klinicznych u chorych z niewydolnością serca
lub po zawale serca (lub okazał się nie gorszy od leku
zmniejszającego śmiertelność)
ACEI – inhibitory konwertazy angiotensyny, ARB – blokery
receptora angiotensynowego, MRA – antagoniści receptora
mineralo-kortykoidowego
|
6. Postępowanie w przypadku skutków
niepożądanych
1) hipotensja bezobjawowa – zwykle nie ma
potrzeby jakiejkolwiek zmiany w leczeniu
2) hipotensja objawowa
a) zawroty głowy zwykle z czasem ustępują i wystarczy uspokoić pacjenta
b) rozważyć, czy konieczne jest dalsze stosowanie
azotanów, blokerów kanału wapniowego i innych leków rozszerzających naczynia
(jeśli chory je przyjmuje); jeśli jest to możliwe
– zmniejszyć ich dawkę lub je odstawić
c) jeśli nie występują objawy przedmiotowe i podmiotowe przewodnienia – rozważyć
zmniejszenie dawki diuretyku
3) kaszel
a) gdy u chorego pojawi się lub nasili kaszel,
należy wykluczyć obrzęk płuc
b) jeśli kaszel jest wywołany przez ACEI
(o czym świadczy np. nawrót po odstawieniu i ponownym włączeniu ACEI) i uciążliwy
(np. nie pozwala spać) – zaleca się zastąpienie
ACEI przez ARB.
4) pogorszenie czynności nerek i hiperkaliemia.
Po rozpoczęciu leczenia ACEI może wystąpić
wzrost stężeń mocznika, kreatyniny i potasu
we krwi, ale zwykle jest on niewielki i bezobjawowy, i nie ma potrzeby podejmowania
jakichkolwiek działań. Jeśli wzrost stężenia
kreatyniny przekracza 50% wartości wyjściowej
lub 266 µmol/l (3 mg/dl), eGFR zmniejszy
się <25 ml/min/1,73 m2, lub stężenie potasu
przekroczy 5,5 mmol/l – należy rozważyć
odstawienie przyjmowanych leków nefrotoksycznych
(np. NSLPZ) i suplementu potasu
lub leku oszczędzającego potas (triamteren,
amiloryd), a jeśli nie ma objawów przedmiotowych
przewodnienia – zmniejszyć dawkę
diuretyku. Jeśli stężenie kreatyniny lub
potasu nadal jest istotnie zwiększone – należy
zmniejszyć dawkę ACEI (lub ARB) o połowę i wykonać kontrolne badania biochemiczne
krwi w ciągu 1–2 tygodni. Jeśli nie wystąpi
pożądany efekt, wskazana jest konsultacja
specjalistyczna, a w przypadku wzrostu stężenia
potasu >5,5 mmol/l lub stężenia kreatyniny o >100% bądź >310 µmol/l (3,5 mg/dl),
lub eGFR <20 ml/min/1,73 m2 – dodatkowo
odstawienie leku. Badania biochemiczne krwi
należy wykonywać często, aż stężenia potasu i kreatyniny się ustabilizują.
β-blokery w skurczowej niewydolności
serca
1. Wskazania:
1) potencjalnie wszyscy chorzy ze stabilną, lekką
lub umiarkowaną skurczową NS (LVEF ≤40%);
chorzy z ciężką NS również odnoszą korzyści z leczenia β-blokerem, ale powinno się je rozpoczynać
pod nadzorem specjalistycznym
2) leki pierwszego rzutu (w skojarzeniu z ACEI i MRA) u chorych ze stabilną NS; należy rozpocząć
ich stosowanie możliwie jak najwcześniej w przebiegu choroby.
2. Przeciwwskazania:
1) astma (przewlekła obturacyjna choroba płuc
[POChP] nie jest przeciwwskazaniem)
2) blok AV II lub III stopnia (jeśli chory nie ma
wszczepionego stymulatora).
3. Należy zachować ostrożność w sytuacji:
1) ciężkiej NS (IV klasa NYHA)
2) aktualnego lub niedawno przebytego (<4 tyg.)
zaostrzenia NS (np. wymagającego hospitalizacji), bloku serca lub częstotliwości rytmu <60/min
3) utrzymujących się objawów podmiotowych przewodnienia,
objawowej hipotensji lub ciśnienia
tętniczego skurczowego <90 mm Hg, zwiększonego
ciśnienia w żyłach szyjnych, wodobrzusza,
wyraźnych obrzęków obwodowych – przed rozpoczęciem
leczenia β-blokerem należy podjąć
próbę osiągnięcia euwolemii.
4. Należy zwracać uwagę na interakcje
lekowe (ze względu na ryzyko wystąpienia bradykardii
lub bloku AV) z:
1) werapamilem i diltiazemem (te leki należy
odstawić)
2) digoksyną, amiodaronem i iwabradyną.
5. Dawkowanie i monitorowanie
1) rozpocząć od małej dawki (tab. 6)
2) podwajać dawkę nie częściej niż co 2 tygodnie
(można szybciej u chorych hospitalizowanych
lub ściśle monitorowanych, jeśli lek jest dobrze
tolerowany)
3) dążyć do osiągnięcia dawki docelowej (tab. 6)
lub największej tolerowanej
4) monitorować częstotliwość rytmu serca i ciśnienie
tętnicze oraz objawy podmiotowe i przedmiotowe
(zwłaszcza objawy przewodnienia, w tym masę ciała).
6. Postępowanie w przypadku skutków
niepożądanych
1) nasilone objawy przewodnienia – zwiększyć
dawkę diuretyku lub zmniejszyć o połowę
dawkę β-blokera (jeśli zwiększenie dawki diuretyku
nie przyniesie pożądanego efektu)
2) wyraźne osłabienie – zmniejszyć dawkę
β-blokera o połowę (rzadko konieczne), ponownie
ocenić chorego po upływie 1–2 tygodni; jeśli
nie ma poprawy, skierować chorego do specjalisty
3) częstotliwość rytmu serca ≤50/min i nasilenie
objawów podmiotowych – zmniejszyć
dawkę β-blokera o połowę, a jeśli objawy są
bardzo nasilone – odstawić β-bloker (rzadko
konieczne). Należy rozważyć, czy konieczne
jest dalsze stosowanie innych leków zwalniających
czynność serca (np. digoksyny, amiodaronu),
jeśli chory je przyjmuje. Należy też
wykonać elektrokardiogram w celu wykluczenia
bloku serca.
4) hipotensja bezobjawowa – zwykle nie ma
potrzeby jakiejkolwiek zmiany w leczeniu
5) hipotensja objawowa
a) rozważyć, czy konieczne jest dalsze stosowanie
azotanów, blokerów kanału wapniowego i innych leków rozszerzających naczynia
(jeśli chory je przyjmuje); jeśli jest to możliwe
– zmniejszyć ich dawkę lub je odstawić
b) jeśli nie występują objawy przedmiotowe i podmiotowe przewodnienia – rozważyć
zmniejszenie dawki diuretyku.
MRA w skurczowej niewydolności
serca
1. Wskazania: potencjalnie wszyscy chorzy z utrzymującymi się objawami (NYHA II–IV) i LVEF ≤35% pomimo leczenia ACEI (lub ARB) i β-blokerem
2. Należy zachować ostrożność w sytuacji:
1) hiperkaliemii (K+ >5,0 mmol/l)
2) istotnej dysfunkcji nerek (kreatyninemia >221 µm/l [2,5 mg/dl] lub eGFR <30 ml/min/1,73 m2)
3. Należy zwracać uwagę na interakcje lekowe (p. wyżej [ACEI]
4. Przeciwwskazania: nie powinno się stosować
eplerenonu w skojarzeniu z silnymi inhibitorami
CYP3A4, takimi jak ketokonazol, itrakonazol,
nefazodon, telitromycyna, klarytromycyna,
rytonawir i nelfinawir.
5. Dawkowanie i monitorowanie
1) sprawdzić czynność nerek i stężenia elektrolitów
we krwi (szczególnie potasu)
2) rozpocząć od małej dawki (tab. 6)
3) rozważyć zwiększenie dawki po upływie 4–8 tygodni
4) wykonać kontrolne badania biochemiczne krwi
po tygodniu i po 4 tygodniach od rozpoczęcia
stosowania MRA lub zwiększenia dawki,
następnie po 8 i 12 tygodniach, 6, 9 i 12 miesiącach,
później co 4 miesiące
6. Postępowanie w przypadku skutków
niepożądanych
Jeśli stężenie potasu wzrośnie >5,5 mmol/l
lub stężenie kreatyniny wzrośnie do 221 µmol/l
(2,5 mg/dl) lub eGFR <30 ml/min/1,73 m2 – zmniejszyć
dawkę o połowę i wykonać kontrolne badania
biochemiczne krwi. Jeśli stężenie potasu
wzrośnie >6,0 mmol/l lub stężenie kreatyniny
wzrośnie do >310 µmol/l (3,5 mg/dl), lub eGFR
<20 ml/min/1,73 m2 – niezwłocznie odstawić MRA i skierować chorego do specjalisty.
Diuretyki w niewydolności serca
(ze zmniejszoną lub zachowaną LVEF)
1. Wskazania:
1) potencjalnie wszyscy chorzy z objawami podmiotowymi i przedmiotowymi przewodnienia, niezależnie od wartości LVEF
2) u chorych ze zmniejszoną LVEF należy zawsze
stosować w połączeniu z ACEI (lub ARB), β-blokerem i MRA
3) Należy stosować w najmniejszej dawce koniecznej
do utrzymania euwolemii (tzn. pacjent nie
ma objawów podmiotowych i przedmiotowych
przewodnienia). W zależności od wolemii może
być konieczne zwiększenie lub zmniejszenie
dawki (pacjenta można nauczyć samodzielnego
modyfikowania dawki diuretyku w razie
potrzeby, na podstawie występujących objawów
podmiotowych, przedmiotowych i zmiany masy
ciała).
2. Przeciwwskazania:
1) Diuretyki nie są wskazane, jeśli u pacjenta
nigdy nie występowały objawy podmiotowe lub
przedmiotowe przewodnienia.
2) wystąpienie reakcji alergicznej lub innej reakcji
niepożądanej (swoistej dla leku).
3. Należy zachować ostrożność w sytuacji:
1) hipokaliemii (K+ ≤3,5 mmol/l) – diuretyk może ją nasilić
2) istotnej dysfunkcji nerek (kreatyninemia >221 µmol/l [2,5 mg/dl] lub eGFR
<30 ml/min/1,73 m2) – diuretyk może ją nasilić
albo może być nieskuteczny (zwłaszcza diuretyk tiazydowy).
3) objawowej lub ciężkiej bezobjawowej hipotensji
(ciśnienie tętnicze skurczowe <90 mm Hg)
– może ulec nasileniu w wyniku hipowolemii
wywołanej przez diuretyk.
4. Należy zwracać uwagę na interakcje
lekowe z:
1) ACEI, ARB i inhibitorami reniny – ryzyko hipotensji
(zwykle nie stanowi problemu)
2) z innym diuretykiem (np. diuretyk pętlowy z diuretykiem tiazydowym) – ryzyko hipowolemii,
hipotensji, hipokaliemii i pogorszenia
czynności nerek
3) NSLPZ – mogą upośledzać działanie diuretyku.
5. Dawkowanie i monitorowanie
1) sprawdzić czynność nerek i stężenia elektrolitów
we krwi
2) rozpocząć od małej dawki (tab. 5)
3) modyfikować dawkę w zależności od objawów
podmiotowych i przedmiotowych przewodnienia, ciśnienia tętniczego i czynności nerek
4) wykonać kontrolne badanie biochemiczne
krwi (mocznik, kreatynina, potas) po upływie
1–2 tygodni od rozpoczęcia leczenia i każdego
zwiększenia dawki diuretyku
5) w razie niedostatecznej odpowiedzi lub oporności
na diuretyki – sprawdzić, czy pacjent
przyjmuje leki i ilość przyjmowanych płynów;
zwiększyć dawkę diuretyku; rozważyć zastąpienie
furosemidu bumetanidem lub torasemidem;
dodać MRA lub zwiększyć jego dawkę; połączyć
diuretyk pętlowy z diuretykiem tiazydowym
lub metolazonem; podawać diuretyk pętlowy 2 razy dziennie (lub częściej) lub na czczo, rozważyć
krótkoterminowe podawanie diuretyku
pętlowego we wlewie dożylnym; rozważyć ultrafiltrację.
6. Postępowanie w przypadku skutków
niepożądanych
1) hipotensja bezobjawowa – można zmniejszyć
dawkę diuretyku, jeśli nie ma objawów podmiotowych i przedmiotowych przewodnienia
2) hipotensja objawowa
a) zawroty głowy – zmniejszyć dawkę, jeśli nie
ma objawów podmiotowych i przedmiotowych
przewodnienia
b) rozważyć, czy konieczne jest dalsze stosowanie
azotanów, blokerów kanału wapniowego i innych leków rozszerzających naczynia
(jeśli chory je przyjmuje)
3) hipokaliemia – zwiększyć dawkę ACEI (lub
ARB), dodać MRA, suplement potasu
4) hipomagnezemia – zastosować suplement
magnezu
5) hiponatremia
a) z oligowolemią – odstawić diuretyk tiazydowy
lub zmienić go na diuretyk pętlowy (jeśli to
możliwe); zmniejszyć dawkę lub odstawić
diuretyk pętlowy (jeśli to możliwe)
b) z hiperwolemią – ograniczyć podaż płynów,
zwiększyć dawkę diuretyku pętlowego; rozważyć
zastosowanie antagonisty wazopresyny
(np. tolwaptanu, jeśli jest dostępny);
zastosować dożylnie lek inotropowy; rozważyć
ultrafiltrację
6) hiperurykemia, dna moczanowa – rozważyć
profilaktyczne stosowanie allopurynolu; w dnie
objawowej stosować kolchicynę, unikać stosowania
NSLPZ
7) hipowolemia, odwodnienie – ocenić wolemię;
rozważyć zmniejszenie dawki diuretyku
8) upośledzenie czynności nerek (wzrost stężenia
kreatyniny lub mocznika)
a) sprawdzić, czy nie ma hipowolemii/odwodnienia
oraz czy chory nie przyjmuje leków nefrotoksycznych
(np. NSLPZ, trimetoprymu)
b) odstawić MRA
c) jeśli chory otrzymuje jednocześnie diuretyk
pętlowy i diuretyk tiazydowy – odstawić diuretyk
tiazydowy
d) rozważyć zmniejszenie dawki ACEI/ARB
e) rozważyć hemofiltrację lub dializę.
Wszczepialny kardiowerter-defibrylator i terapia resynchronizująca u chorych z niewydolnością serca ze zmniejszoną frakcją wyrzutową (skurczową niewydolnością serca)
Zalecenia dotyczące stosowania wszczepialnego
kardiowertera-defibrylatora (ICD)
Zaleca się stosowanie ICD:
1) w ramach prewencji wtórnej u chorych z arytmią
komorową powodującą niestabilność hemodynamiczną
– w celu zmniejszenia ryzyka
nagłego zgonu [I/A]
2) w ramach prewencji pierwotnej u chorych z objawową NS (NYHA II–III) i LVEF ≤35%
pomimo stosowania przez ≥3 miesiące optymalnej
farmakoterapii – w celu zmniejszenia
ryzyka nagłego zgonu [I/A dla etiologii niedokrwiennej i >40 dni po zawale serca; I/B dla
etiologii nie-niedokrwiennej].
Powyższe zalecenie dotyczy chorych, których
spodziewany czas przeżycia w dobrym stanie czynnościowym
wynosi >1 rok.
Zalecenia dotyczące stosowania
CRT u chorych ze zmniejszoną LVEF
pomimo optymalnego leczenia
farmakologicznego
Chorzy z rytmem zatokowym, w III lub IV
(niewymagający hospitalizacji) klasie NYHA
(zalecenia dotyczą chorych, których spodziewany
czas przeżycia w dobrym stanie czynnościowym
wynosi >1 rok)
1. Zaleca się stosowanie CRT-P (CRT z funkcją
stymulatora)/CRT-D (CRT z funkcją defibrylatora) u chorych z QRS ≥120 ms, morfologią QRS odpowiadającą
LBBB i LVEF ≤35% – w celu zmniejszenia
ryzyka hospitalizacji i przedwczesnego zgonu z powodu NS [I/A].
2. Należy rozważyć stosowanie CRT-P/CRT-D u chorych z QRS ≥150 ms niezależnie od morfologii
QRS, z LVEF ≤35% – w celu zmniejszenia ryzyka
hospitalizacji i przedwczesnego zgonu z powodu
NS [IIa/A].
Chorzy z rytmem zatokowym, w II klasie NYHA
(zalecenia dotyczą chorych, których spodziewany
czas przeżycia w dobrym stanie czynnościowym
wynosi >1 rok)
1. Zaleca się stosowanie CRT (lepiej CRT-D) u chorych z QRS ≥130 ms, morfologią QRS odpowiadającą
LBBB, i LVEF ≤30% – w celu zmniejszenia
ryzyka hospitalizacji i przedwczesnego
zgonu z powodu NS [I/A].
2. Należy rozważyć stosowanie CRT (lepiej
CRT-D) u chorych z QRS ≥150 ms, niezależnie
od morfologii QRS, i z LVEF ≤30% – w celu zmniejszenia
ryzyka hospitalizacji i przedwczesnego
zgonu z powodu NS [IIa/A].
Chorzy z utrwalonym migotaniem
przedsionków, w III lub IV (niewymagający
hospitalizacji) klasie NYHA
(zalecenia dotyczą chorych, których spodziewany
czas przeżycia w dobrym stanie czynnościowym
wynosi >1 rok)
Można rozważyć stosowanie CRT-P/CRT-D u chorych z QRS ≥120 ms i LVEF ≤35% – w celu
zmniejszenia ryzyka pogorszenia NS, jeśli:
1) chory wymaga stymulacji z powodu wolnego
własnego rytmu komór [IIb/C]
2) chory jest zależny od stymulatora w wyniku
ablacji węzła AV [IIb/C]
3) częstotliwość rytmu komór wynosi w spoczynku ≤60/min i podczas wysiłku ≤90/min [IIb/C].
Chorzy ze wskazaniami do konwencjonalnej
stymulacji i bez innych wskazań do CRT
1. Należy rozważyć stosowanie CRT u chorych w III lub IV klasie NYHA i z LVEF ≤35%,
niezależnie od czasu trwania zespołu QRS – w celu
zmniejszenia ryzyka nasilenia NS [IIa/C].
2. Można rozważyć stosowanie CRT u chorych w II klasie NYHA z LVEF ≤35%, niezależnie
od czasu trwania zespołu QRS – w celu zmniejszenia
ryzyka pogorszenia NS [IIb/C].
Postępowanie u chorych z niewydolnością serca i chorobami współistniejącymi
Zalecenia dotyczące kontroli
częstotliwości rytmu komór u chorych z objawową NS (NYHA
II–IV), dysfunkcją skurczową lewej
komory, utrzymującym się, utrwalonym
migotaniem przedsionków i bez cech
ostrej dekompensacji
Krok 1
1. Zaleca się:
1) stosowanie β-blokera jako preferowanego leku
pierwszego wyboru w celu kontroli częstotliwości
rytmu komór – ze względu na korzyści z takiej terapii (zmniejszenie ryzyka hospitalizacji z powodu nasilenia NS i zmniejszenie
ryzyka przedwczesnego zgonu) [I/A]
2) digoksyny u chorych nietolerujących β-blokerów
[I/B].
2. Można rozważyć
1) stosowanie amiodaronu u chorych nietolerujących
β-blokerów i digoksyny [IIb/C]
2) ablację węzła AV i stymulację (możliwie CRT) u chorych nietolerujących β-blokerów, digoksyny i amiodaronu [IIb/C].
Krok 2
1. Zaleca się stosowanie digoksyny jako preferowanego
leku drugiego wyboru w skojarzeniu z β-blokerem – w celu kontroli częstotliwości rytmu
komór u chorych z niedostateczną odpowiedzią
na β-bloker [I/B].
2. Należy rozważyć stosowanie nie więcej niż 2 spośród następujących 3 leków – β-bloker, digoksyna i amiodaron (lub jakikolwiek inny lek hamujący
przewodzenie w sercu), z powodu ryzyka ciężkiej
bradykardii, bloku AV III° i asystolii [IIa/C].
3. Można rozważyć stosowanie:
1) amiodaronu w skojarzeniu z β-blokerem albo
digoksyną (ale nie oboma tymi lekami jednocześnie) w celu kontroli częstotliwości rytmu
komór u chorych z niedostateczną odpowiedzią
na β-bloker lub digoksynę bądź nietolerujących
skojarzenia tych leków [IIb/C]
2) ablacji węzła AV i stymulacji (możliwie CRT) u chorych z niedostateczną odpowiedzią na 2 z 3 następujących leków: β-bloker, digoksyna i amiodaron [IIb/C].
Zalecenia dotyczące kontroli
(przywrócenia i utrzymania) rytmu
zatokowego u chorych z migotaniem
przedsionków, objawową NS (NYHA
II–IV) i dysfunkcją skurczową lewej
komory bez cech ostrej dekompensacji
1. Można rozważyć:
1) kardiowersję elektryczną lub farmakologiczną z użyciem amiodaronu u chorych z utrzymującymi
się objawami podmiotowymi i/lub przedmiotowymi
NS pomimo optymalnego leczenia
farmakologicznego i odpowiedniej kontroli
częstotliwości rytmu komór – w celu poprawy
stanu klinicznego [IIb/C]
2) stosowanie amiodaronu przed udaną kardiowersją
elektryczną i po niej – w celu utrzymania
rytmu zatokowego [IIb/C].
2. Nie zaleca się stosowania:
1) dronedaronu – ponieważ zwiększa ryzyko
hospitalizacji z przyczyn sercowo-naczyniowych i ryzyko przedwczesnego zgonu [III/A]
2) leków antyarytmicznych klasy I – ponieważ
zwiększają ryzyko przedwczesnego zgonu [III/A].
Zalecenia dotyczące zapobiegania
powikłaniom zakrzepowo-zatorowym u chorych z objawową NS (NYHA
II–IV) i napadowym lub utrwalonym
migotaniem przedsionków
1. Zaleca się:
1) używanie skali CHA2DS2-VASc (tab. 7) i HAS-BLED (tab. 8) – w celu oceny bilansu
ryzyka krwawienia i korzyści z zapobiegania
powikłaniom zakrzepowo-zatorowym związanych
ze stosowaniem doustnej antykoagulacji [I/B]
2) stosowanie doustnego antykoagulantu u wszystkich chorych z punktacją ≥1 w skali
CHA2DS2-VASc bez przeciwwskazań i niezależnie
od tego, czy stosuje się strategię kontroli
częstotliwości rytmu, czy kontroli rytmu serca
(dotyczy to także chorych po skutecznej kardiowersji)
[I/A]
3) stosowanie doustnego antykoagulantu w dawce
terapeutycznej przez ≥3 tygodnie przed kardiowersją
elektryczną lub farmakologiczną u chorych, u których AF trwa ≥48 godzin lub czas
trwania AF nie jest znany [I/C]
4) stosowanie heparyny niefrakcjonowanej dożylnie
lub heparyny drobnocząsteczkowej (HDCz) u chorych dotychczas nieleczonych antykoagulantem,
wymagających kardiowersji elektrycznej lub
farmakologicznej w trybie pilnym [I/C]. U takich
chorych jako postępowanie alternatywne można
rozważyć wykonanie w pierwszej kolejności
echokardiografii przezprzełykowej [IIb/C].
3. Nie zaleca się stosowania antykoagulantu
doustnego w skojarzeniu z lekiem przeciwpłytkowym u chorych z przewlekłą (>12 miesięcy
od ostrego incydentu) chorobą wieńcową lub
chorobą innego łożyska tętniczego – ze względu
na duże ryzyko poważnego krwawienia [III/A].
Po upływie 12 miesięcy preferuje się leczenie
samym doustnym antykoagulantem.
Tabela 7. Skala CHA2DS2-VASc do oceny ryzyka udaru niedokrwiennego
mózgu u chorych z migotaniem przedsionków niezwiązanym z wadą zastawkową
| Czynnik ryzyka | Punkty |
| zastoinowa niewydolność serca/dysfunkcja lewej komory | 1 |
| nadciśnienie tętnicze | 1 |
| wiek ≥75 lat | 2 |
| cukrzyca | 1 |
| przebyty udar mózgu/TIA/incydent zakrzepowo-zatorowy | 2 |
| choroba naczyniowaa | 1 |
| wiek 65–74 lat | 1 |
| płeć żeńska | 1 |
| suma punktów – roczne ryzyko udaru |
| 0 pkt – 0%, 1 pkt – 1,3%, 2 pkt – 2,2%, 3 pkt – 3,2%, 4 pkt – 4,0%, 5 pkt – 6,7%, 6 pkt – 9,8%, 7 pkt – 9,6%, 8 pkt – 6,7%, 9 pkt – 15,2% |
| a przebyty zawał serca, miażdżycowa choroba tętnic obwodowych, blaszki miażdżycowe w aorcie |
Tabela 8. Skala HAS-BLED do oceny ryzyka krwawienia u chorych z migotaniem przedsionków
| Czynnik | Punkty |
| nadciśnienie tętniczea (Hypertension) | 1 |
| nieprawidłowa czynność nerekb lub wątrobyc (Abnormal renal and liver function) | 1 lub 2 |
| udar mózgu (Stroke) | 1 |
| krwawienied (Bleeding) | 1 |
| niestabilne wartości INRe (Labile INRs) | 1 |
| podeszły wiek, tzn. >65 lat (Elderly) | 1 |
| lekif lub alkohol (Drugs or alcohol ) | 1 lub 2 |
| interpretacja: ≥3 pkt = duże ryzyko |
a ciśnienie tętnicze skurczowe >160 mm Hg
b przewlekła dializoterapia, stan po przeszczepieniu nerki lub stężenie kreatyniny w surowicy
>200 µmol/l
c przewlekła choroba wątroby (np. marskość) lub cechy biochemiczne istotnego uszkodzenia
wątroby (np. bilirubina >2 × górna granica normy + ALT/AST/fosfataza zasadowa >3 × górna
granica normy)
d krwawienie w wywiadzie i/lub predyspozycja do krwawień (np. skaza krwotoczna,
niedokrwistość itd.)
e wahające się duże wartości lub często poza przedziałem terapeutycznym (np. >40%
oznaczeń)
f jednoczesne przyjmowanie leków przeciwpłytkowych lub niesteroidowych leków
przeciwzapalnych
|
Zalecenia dotyczące leczenia arytmii
komorowych u chorych z NS
1. Zaleca się:
1) poszukiwanie i korygowanie czynników mogących
nasilać lub wywoływać arytmię komorową
(np. zaburzeń elektrolitowych, przyjmowania
leków proarytmicznych, niedokrwienia mięśnia
sercowego) [I/C]
2) optymalizację leczenia ACEI (lub ARB),
β-blokerem i MRA [I/A]
3) rozważenie rewaskularyzacji u chorych na chorobę
wieńcową [I/C]
4) wszczepienie ICD u chorych z objawową lub
utrwaloną arytmią komorową (częstoskurczem
komorowym lub migotaniem komór), których
stan czynnościowy jest dostatecznie dobry i u których celem leczenia jest poprawa przeżywalności
[I/A]
5) stosowanie amiodaronu u chorych z ICD, u których
nadal występują epizody objawowej arytmii
komorowej lub nawracające wyładowania
ICD pomimo optymalnego leczenia i przeprogramowania
ICD [I/C]
6) wykonanie ablacji u chorych z ICD, u których
nawracają epizody arytmii komorowej wywołujące
wyładowania ICD pomimo optymalnego
leczenia, przeprogramowania ICD i stosowania
amiodaronu [I/C].
2. Można rozważyć stosowanie amiodaronu w celu zapobiegania nawrotom epizodów utrwalonej
objawowej arytmii komorowej u optymalnie
leczonych chorych, u których wszczepienie ICD
uważa się za niewłaściwe [IIb/C].
3. Nie zaleca się:
1) rutynowego stosowania amiodaronu u chorych z nieutrwaloną arytmią komorową – ze względu
na to, że nie udowodniono korzyści z takiego
postępowania oraz ze względu na potencjalną
toksyczność leku [III/A]
2) stosowania innych leków antyarytmicznych
(szczególnie klasy IC i dronedaronu) u chorych
ze skurczową NS – ze względu na ryzyko
nasilenia NS, wystąpienia proarytmii i zgonu
[III/A].
Zalecenia dotyczące leczenia
farmakologicznego stabilnej dławicy
piersiowej u chorych z objawową NS
(NYHA II–IV) i skurczową dysfunkcją
lewej komory
Krok 1
1. Zaleca się stosowanie β-blokera jako preferowanego
leku pierwszego wyboru w celu zniesienia
dławicy piersiowej – ze względu na korzyści z takiej terapii (zmniejszenie ryzyka hospitalizacji i przedwczesnego zgonu z powodu NS) [I/A].
2. Należy rozważyć – jako alternatywę dla
β-blokera u chorych nietolerujących tych leków –
stosowanie:
1) iwabradyny u chorych z rytmem zatokowym
[IIa/A]
2) doustnego lub przezskórnego azotanu [IIa/A]
3) amlodypiny [IIa/A].
Wyżej wymienione leki mają potwierdzoną
skuteczność przeciwdławicową i bezpieczeństwo w NS.
3. Można rozważyć stosowanie:
1) nikorandylu [IIb/C]
2) ranolazyny [IIb/C].
Wyżej wymienione leki mają potwierdzoną skuteczność
przeciwdławicową, ale niepewne bezpieczeństwo w NS.
Krok 2 (dodanie drugiego leku
przeciwdławicowego, gdy dławica piersiowa
się utrzymuje pomimo leczenia β-blokerem
lub lekiem alternatywnym)
1. Zaleca się dodanie:
1) iwabradyny [I/A]
2) doustnego lub przezskórnego azotanu [I/A]
3) amlodypiny [I/A].
Wyżej wymienione leki mają potwierdzoną
skuteczność przeciwdławicową i bezpieczeństwo w NS.
2. Można rozważyć dodanie:
1) nikorandylu [IIb/C]
2) ranolazyny [IIb/C].
Wyżej wymienione leki mają potwierdzoną skuteczność
przeciwdławicową, ale niepewne bezpieczeństwo w NS.
Krok 3
1. U chorych, u których dławica piersiowa się
utrzymuje pomimo leczenia 2 lekami przeciwdławicowymi,
zaleca się rewaskularyzację wieńcową (p. dalej) [I/A].
2. Jako postępowanie alternatywne można
rozważyć dodanie trzeciego leku przeciwdławicowego, z wyjątkiem wymienionych poniżej [IIb/C].
3. Nie zaleca się:
1) łączenia iwabradyny, ranolazyny i nikorandylu
– ze względu na nieznane bezpieczeństwo
takiego leczenia [III/C]
2) łączenia nikorandylu z azotanem – ze względu
na nieudowodnione zwiększenie skuteczności
[III/C]
3) stosowania diltiazemu i werapamilu –
ze względu na ujemne działanie inotropowe i ryzyko nasilenia NS [III/B].
Zalecenia dotyczące leczenia
nadciśnienia tętniczego u chorych z objawową NS (NYHA II–IV) i dysfunkcją skurczową lewej komory
Krok 1
Zaleca się stosowanie (pojedynczo lub w skojarzeniu)
ACEI (lub ARB), β-blokera i MRA jako leków
odpowiednio pierwszego, drugiego i trzeciego
wyboru – ze względu na korzyści z takiej terapii
(zmniejszenie ryzyka hospitalizacji i przedwczesnego
zgonu z powodu NS) [I/A].
Krok 2
Zaleca się stosowanie diuretyku tiazydowego
(a u chorych już leczonych diuretykiem tiazydowym
jego zmianę na diuretyk pętlowy), jeśli nadciśnienie
tętnicze się utrzymuje pomimo leczenia
ACEI (ARB), β-blokerem i MRA [I/C].
Krok 3 (nadciśnienie tętnicze się utrzymuje
pomimo leczenia ACEI (lub ARB), β-blokerem,
MRA i diuretykiem)
1. Zaleca się stosowanie:
1) amlodypiny [I/A] lub
2) hydralazyny [I/A].
2. Należy rozważyć stosowanie felodypiny
[IIa/B].
3. Nie zaleca się stosowania:
1) moksonidyny – ponieważ zwiększa śmiertelność
[III/B]
2) antagonistów receptora adrenergicznego α –
ze względu na aktywację neurohormonalną,
zatrzymywanie wody w ustroju i nasilenie NS
[III/A].
Ostra niewydolność serca
1. Ostrą niewydolnością serca (ONS) nazywa
się szybkie wystąpienie lub zmianę objawów podmiotowych i przedmiotowych NS. Jest to stan
zagrażający życiu, który wymaga natychmiastowej
pomocy medycznej i zwykle prowadzi do przyjęcia
do szpitala w trybie pilnym.
2. W większości przypadków ONS jest wynikiem
nasilenia wcześniej rozpoznanej NS
(ze zmniejszoną lub zachowaną LVEF). U takich
chorych często stwierdza się oczywisty czynnik
wywołujący (np. arytmię lub zaprzestanie leczenia
moczopędnego u chorych z NS ze zmniejszoną
LVEF; przeciążenie objętościowe lub ciężkie nadciśnienie
tętnicze u chorych z NS z zachowaną
LVEF).
3. Czynniki, które zwykle prowadzą
do szybkiego pogorszenia NS:
1) szybka arytmia, ciężka bradykardia, zaburzenie
przewodzenia
2) ostry zespół wieńcowy (OZW)
3) mechaniczne powikłanie OZW (np. pęknięcie
przegrody międzykomorowej, pęknięcie struny ścięgnistej zastawki mitralnej, zawał prawej
komory)
4) ostra zatorowość płucna
5) przełom nadciśnieniowy
6) tamponada serca
7) rozwarstwienie aorty
8) operacja i powikłania w okresie okołooperacyjnym
9) kardiomiopatia połogowa.
4. Czynniki, które zwykle prowadzą
do wolniejszego nasilenia NS:
1) zakażenie (w tym infekcyjne zapalenie wsierdzia)
2) zaostrzenie POChP lub astmy
3) niedokrwistość
4) dysfunkcja nerek
5) nieprzestrzeganie diety lub przyjmowania leków
6) czynniki jatrogenne (np. stosowanie NSLPZ lub glikokortykosteroidów, interakcje lekowe)
7) arytmie, bradykardia i zaburzenia przewodzenia niepowodujące nagłej dużej zmiany
częstotliwości rytmu serca
8) niekontrolowane nadciśnienie tętnicze
9) niedoczynność lub nadczynność tarczycy
10) nadużywanie alkoholu i substancji psychoaktywnych.
Leczenie ostrej niewydolności serca
Zalecenia dotyczące leczenia chorych z ostrą NS
Algorytm postępowania w ostrym obrzęku płuc – p. rycina 2.
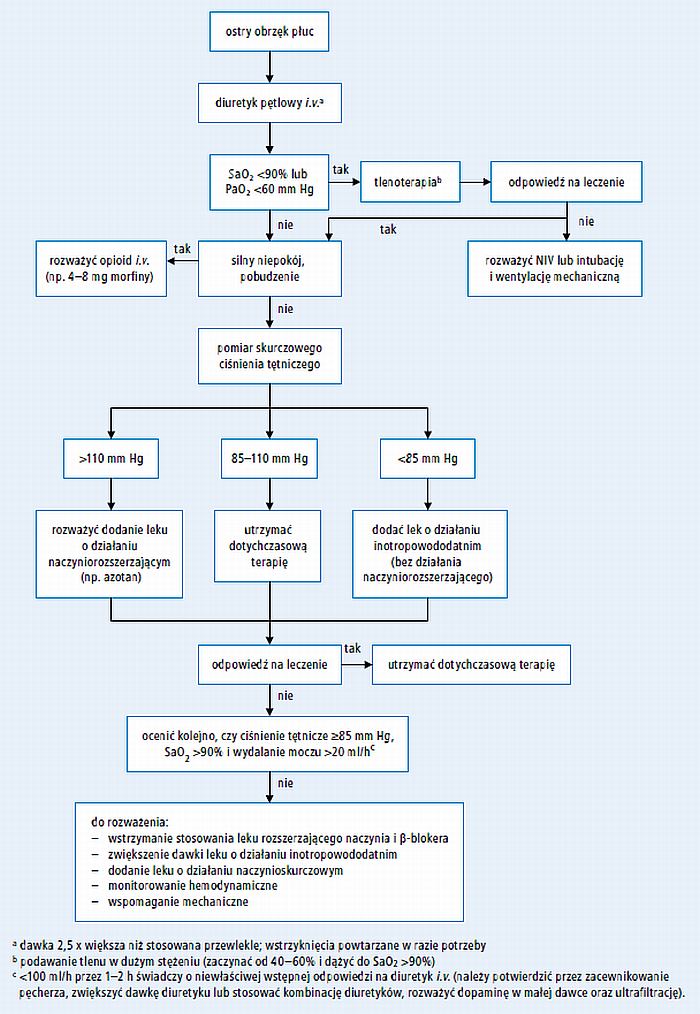
Ryc. 2. Algorytm postępowania w ostrym obrzęku płuc (na podstawie wytycznych ESC 2012, zmodyfikowane)
Dawkowanie najczęściej stosowanych leków
przedstawiono w tabeli 9.
Tabela 9. Leki stosowane dożylnie w ostrej niewydolności serca
| Lek | Dawkowanie |
| leki rozszerzające naczynia |
| nitrogliceryna | początkowo 10–20 µg/min, zwiększaj w razie potrzeby
do maks. 200 µg/min |
| diazotan izosorbidu | początkowo 1 mg/h, maks. do 10 mg/h |
| nitroprusydek sodu | początkowo 0,3 µg/kg/min, maks. do 5 µg/kg/min |
nezyrytyd
(rekombinowany ludzki BNP) | wstrzyknięcie 2 µg/min + wlew 0,015–0,03 µg/kg/min |
| leki o dodatnim działaniu inotropowym lub kurczące naczynia |
| dobutamina | 2–20 µg/kg/min |
| dopamina | <3 µg/kg/min – efekt nerkowy
3–5 µg/kg/min – efekt inotropowy
>5 µg/kg/min – efekt naczynioskurczowy |
| milrynon | wstrzyknięcie 25–75 µg/kg w ciągu 10–20 min, następnie 0,375–0,75 µg/kg/min |
| enoksymon | wstrzyknięcie 0,5–1,0 mg/kg, następnie 5–20 µg/kg/min |
| lewosymendan | wstrzyknięcie 12 µg/kg w ciągu 10 min (nie zaleca się, gdy skurczowe ciśnienie tętnicze <100 mm Hg), następnie 0,1 µg/kg/min (0,05–0,2 µg/kg/min) |
| noradrenalina | 0,2–1,0 µg/kg/min |
| adrenalina | wstrzyknięcie 1 mg co 3–5 min podczas resuscytacji, 0,05–0,5 µg/kg/min |
| na podstawie wytycznych ESC 2012, zmodyfikowane |
Chorzy z zastojem w płucach lub obrzękiem
płuc niebędący w stanie wstrząsu
1. Zaleca się stosowanie:
1) diuretyku pętlowego dożylnie – w celu zniesienia
duszności i zastoju; w czasie jego stosowania
należy regularnie monitorować objawy
podmiotowe, diurezę, parametry czynności
nerek i stężenie elektrolitów w surowicy [I/B]
2) tlenu (z dużym przepływem) u chorych z wysyceniem
hemoglobiny tlenem w pomiarze pulsoksymetrycznym
<90% lub z PaO2 <60 mm Hg
– w celu zniesienia hipoksemii [I/C]
3) profilaktyki powikłań zakrzepowo-zatorowych
(np. za pomocą HDCz) u chorych, którzy
nie przyjmują jeszcze leków przeciwkrzepliwych i którzy nie mają przeciwwskazań do antykoagulacji
– w celu zmniejszenia ryzyka żylnej
choroby zakrzepowo-zatorowej (zakrzepicy żył
głębokich i zatorowości płucnej) [I/A].
2. Należy rozważyć stosowanie:
1) wentylacji nieinwazyjnej (np. CPAP) u chorych z dusznością, obrzękiem płuc i częstotliwością
oddechów >20/min – w celu zniesienia
duszności oraz zmniejszenia hiperkapni i kwasicy
[IIa/B]. Wentylacja nieinwazyjna może spowodować
obniżenie ciśnienia krwi i na ogół nie
powinna być stosowana u chorych z ciśnieniem
tętniczym skurczowym <85 mm Hg (w trakcie
stosowania wentylacji nieinwazyjnej należy
regularnie monitorować ciśnienie krwi)
2) opioidu dożylnie (w połączeniu z lekiem przeciwwymiotnym) u chorych ze szczególnie nasilonym
lękiem, niepokojem – w celu zniesienia
tych objawów i duszności [IIa/C]. W czasie
stosowania opioidu należy często monitorować
stan świadomości i oddychanie, gdyż może dojść
do depresji oddychania.
3) azotanu we wlewie dożylnym u chorych z zastojem w płucach lub obrzękiem płuc i skurczowym
ciśnieniem tętniczym >110 mm Hg, u których
nie występuje ciężkie zwężenie mitralne lub
aortalne – w celu obniżenia ciśnienia zaklinowania w tętnicy płucnej i systemowego oporu
naczyniowego [IIa/B]. Azotany mogą również
spowodować ustąpienie duszności i zastoju krwi. W czasie dożylnego wlewu azotanu należy często
monitorować objawy podmiotowe i ciśnienie
krwi.
3. Można rozważyć dożylny wlew nitroprusydku
sodu u chorych z zastojem w krążeniu
płucnym lub obrzękiem płuc i ciśnieniem tętniczym
skurczowym >110 mm Hg bez ciężkiej stenozy
mitralnej lub aortalnej – w celu obniżenia
ciśnienia zaklinowania w tętnicy płucnej i systemowego
oporu naczyniowego [IIb/B]. Zaleca się
ostrożność u chorych ze świeżym zawałem serca.
Nitroprusydek może również spowodować ustąpienie
duszności i zastoju krwi. W czasie dożylnego wlewu nitroprusydku należy często monitorować
objawy podmiotowe i ciśnienie krwi.
4. Nie zaleca się stosowania leków o działaniu
inotropowym, chyba że występuje hipotensja
(ciśnienie tętnicze skurczowe <85 mm Hg), zmniejszenie
perfuzji lub wstrząs – ze względu na ryzyko
wystąpienia arytmii przedsionkowej lub komorowej,
niedokrwienia mięśnia sercowego i zgonu [III/C].
Chorzy z hipotensją, zmniejszoną perfuzją
lub w stanie wstrząsu
1. Zaleca się kardiowersję elektryczną, jeśli
występuje arytmia przedsionkowa lub komorowa,
która prawdopodobnie przyczynia się do pogorszenia
stanu hemodynamicznego chorego – w celu
przywrócenia rytmu zatokowego i poprawy stanu
klinicznego [I/C].
2. Należy rozważyć stosowanie:
1) dożylnego wlewu leku działającego inotropowo
(np. dobutaminy) u chorych z hipotensją
(ciśnienie tętnicze skurczowe <85 mm Hg)
i/lub ze zmniejszoną perfuzją – w celu zwiększenia
rzutu serca, zwiększenia ciśnienia krwi i poprawy perfuzji obwodowej [IIa/C]. Należy w sposób ciągły monitorować EKG, ponieważ
leki działające inotropowo mogą wywoływać
zaburzenia rytmu serca i niedokrwienie mięśnia
sercowego
2) mechanicznego wspomagania krążenia
krótkoterminowo (jako terapię pomostową) u chorych z utrzymującą się ciężką hipoperfuzją
pomimo stosowania leku inotropowego z potencjalnie
odwracalną przyczyną (np. wirusowym
zapaleniem mięśnia sercowego) lub przyczyną,
którą można skorygować chirurgicznie
(np. ostre pęknięcie przegrody międzykomorowej)
[II/C].
3. Można rozważyć stosowanie:
1) lewosymendanu (lub inhibitora fosfodiesterazy)
we wlewie dożylnym w celu zniesienia
β-blokady, jeśli się uważa, że jest ona odpowiedzialna
za hipoperfuzję [IIb/C]. Należy w sposób
ciągły monitorować EKG, ponieważ leki
inotropowe mogą wywołać arytmię lub niedokrwienie
mięśnia sercowego, a także ciśnienie
krwi, ponieważ lek ten wykazuje też działanie
rozszerzające naczynia
2) leku kurczącego naczynia (np. dopaminy lub
noradrenaliny) u chorych w stanie wstrząsu
kardiogennego pomimo leczenia lekiem inotropowym
– w celu zwiększenia ciśnienia krwi i perfuzji narządów krytycznych dla przeżycia
[IIb/C]. Należy monitorować EKG, ponieważ
leki te mogą wywoływać arytmię i/lub niedokrwienie
mięśnia sercowego, oraz rozważyć
wewnątrztętnicze pomiary ciśnienia krwi.
3) mechaniczne wspomaganie krążenia krótkoterminowo
(jako terapię pomostową) u chorych,
których stan szybko się pogarsza, zanim zostanie
przeprowadzona pełna ocena diagnostyczna [IIb/C].
Chorzy z ostrym zespołem wieńcowym
1. Zaleca się:
1) niezwłoczne wykonanie pierwotnej przezskórnej
interwencji wieńcowej (PCI; lub
pomostowania aortalno-wieńcowego
[CABG] w wybranych przypadkach), jeśli
się rozpozna OZW z uniesieniem odcinka ST lub świeżym LBBB – w celu zmniejszenia rozległości
martwicy kardiomiocytów i zmniejszenia
ryzyka przedwczesnego zgonu [I/A]
2) jako alternatywę dla PCI lub CABG – dożylne
leczenie trombolityczne, jeśli PCI i CABG
nie może być wykonana [I/A]
3) wykonanie wczesnej PCI (lub CABG w wybranych przypadkach), jeśli się rozpozna
OZW bez uniesienia ST – w celu zmniejszenia
ryzyka nawrotu OZW; pilną rewaskularyzację
zaleca się, jeśli stan hemodynamiczny
chorego jest niestabilny [I/A]
4) zastosowanie eplerenonu – w celu zmniejszenia
ryzyka zgonu i hospitalizacji z przyczyn sercowo-naczyniowych u chorych z LVEF ≤40% [I/B]
5) zastosowanie ACEI (lub ARB) u chorych z LVEF ≤40% po ustabilizowaniu stanu klinicznego
– w celu zmniejszenia ryzyka zgonu,
ponownego zawału serca i hospitalizacji z powodu NS [I/A]
6) zastosowanie β-blokera u chorych z LVEF
≤40% po ustabilizowaniu się ich stanu klinicznego
– w celu zmniejszenia ryzyka zgonu i ponownego zawału serca [I/B].
2. Należy rozważyć dożylne stosowanie opioidów
(w połączeniu z lekiem przeciwwymiotnym) u chorych z niedokrwiennym bólem w klatce
piersiowej – w celu jego zniesienia (i zmniejszenia
duszności) [IIa/C]. W czasie stosowania opioidu
należy często monitorować stan świadomości i pracę oddechową, ponieważ może dojść do depresji
oddychania.
Chorzy z migotaniem przedsionków i szybką
czynnością komór
1. Zaleca się:
1) stosowanie pełnej antykoagulacji (np. z użyciem
heparyny dożylnie), jeśli chory dotychczas
nie przyjmował leku przeciwkrzepliwego i nie ma przeciwwskazań do antykoagulacji,
gdy tylko wykryje się AF – w celu zmniejszenia
ryzyka zatorowości tętniczej systemowej i udaru mózgu [I/A]
2) wykonanie kardiowersji elektrycznej u chorych
niestabilnych hemodynamicznie, u których
konieczne jest pilne przywrócenie rytmu
zatokowego – w celu szybkiej poprawy stanu
klinicznego [I/C]
3) rozważenie kardiowersji elektrycznej lub farmakologicznej z użyciem amiodaronu u chorych, u których podjęto decyzję o przywróceniu rytmu zatokowego w trybie niepilnym [I/C]. Taką strategię powinno się przyjmować tylko u chorych z pierwszym epizodem AF trwającym krócej niż 48 godzin (i u chorych bez cech zakrzepu w uszku lewego przedsionka w echokardiografii
przezprzełykowej)
4) rozważenie dożylnego podawania glikozydu
naparstnicy – w celu szybkiego uzyskania
kontroli częstotliwości rytmu komór [I/C].
2. Nie zaleca się stosowania:
1) dronedaronu – ponieważ zwiększa ryzyko
hospitalizacji z przyczyn sercowo-naczyniowych i przedwczesnego zgonu, zwłaszcza u chorych z LVEF ≤40% [III/A]
2) leków antyarytmicznych klasy I – ponieważ
zwiększają ryzyko przedwczesnego zgonu,
szczególnie u chorych z dysfunkcją skurczową
lewej komory [III/A].
Chorzy z ciężką bradykardią lub blokiem
serca
Zaleca się stymulację u chorych niestabilnych
hemodynamicznie z powodu ciężkiej bradykardii
lub bloku serca – w celu poprawy ich stanu klinicznego
[I/C].
Rewaskularyzacja wieńcowa, przeszczepianie serca i mechaniczne wspomaganie
czynności serca
Zalecenia dotyczące rewaskularyzacji
mięśnia sercowego u chorych z przewlekłą NS i dysfunkcją skurczową
lewej komory
1. Zaleca się wykonanie CABG:
1) u chorych z dławicą piersiową i istotnym zwężeniem
pnia lewej tętnicy wieńcowej, którzy
kwalifikują się do operacji i u których przewidywany
czas przeżycia w dobrym stanie czynnościowym
wynosi >1 rok – w celu zmniejszenia
ryzyka przedwczesnego zgonu [I/C]
2) u chorych z dławicą piersiową i chorobą wieńcową
dwu- lub trójnaczyniową obejmującą zwężenie gałęzi międzykomorowej przedniej lewej
tętnicy wieńcowej, kwalifikujących się do operacji, u których spodziewany czas przeżycia w dobrym stanie czynnościowym wynosi >1
rok – w celu zmniejszenia ryzyka hospitalizacji i nagłego zgonu z przyczyn sercowo-naczyniowych
[I/B].
2. Można rozważyć jako alternatywę dla
CABG wykonanie PCI w wyżej wymienionych
kategoriach chorych niekwalifikujących się do operacji
[IIb/C].
3. Nie zaleca się wykonywania CABG i PCI u chorych bez dławicy piersiowej, u których nie
stwierdza się żywotności niedokrwionych obszarów
mięśnia sercowego [III/C].
Przeszczepienie serca
1. Przeszczepienie serca należy rozważyć u chorych
ze schyłkową NS i ciężkimi objawami podmiotowymi, u których rokowanie jest złe i nie ma
alternatywnych opcji leczenia, pod warunkiem
że są zmotywowani, dobrze poinformowani i stabilni
emocjonalnie oraz zdolni do przestrzegania
intensywnego leczenia po transplantacji.
2. Przeciwwskazania do przeszczepienia
serca:
1) czynne zakażenie
2) ciężka choroba tętnic obwodowych lub mózgowych
3) nadużywanie alkoholu lub substancji psychoaktywnych
4) choroba nowotworowa leczona w ciągu ostatnich 5 lat
5) niewyleczony wrzód trawienny
6) niedawno przebyte powikłanie zakrzepowo-zatorowe
7) istotna niewydolność nerek (np. klirens kreatyniny <50 ml/min)
8) istotna choroba wątroby
9) choroba układowa wielonarządowa
10) inne poważne choroby o złym rokowaniu
11) niestabilność emocjonalna lub nieleczona choroba psychiczna
12) wysoki utrwalony opór naczyń płucnych
(>4–5 j. Wooda i średni gradient przezpłucny
>15 mm Hg).
Urządzenie wspomagające czynność lewej komory
Do wszczepienia urządzenia wspomagającego
pracę komory potencjalnie kwalifikują się chorzy z ciężkimi objawami utrzymującymi się >2 miesiące
pomimo optymalnego leczenia farmakologicznego i z użyciem ICD lub CRT, u których
stwierdza się >1 z poniższych czynników:
1) LVEF <25% i (jeśli zmierzone) szczytowe VO2
<12 ml/kg/min
2) ≥3 hospitalizacje z powodu NS w ciągu ostatnich
12 miesięcy, bez wykrytego czynnika wywołującego
3) uzależnienie od leku inotropowego podawanego dożylnie
4) postępująca dysfunkcja narządów (nerek
i/lub wątroby) wskutek zmniejszonej perfuzji, a nie niedostatecznego ciśnienia napełniania
komory (ciśnienie zaklinowania w tętnicy
płucnej ≥20 mm Hg i skurczowe ciśnienie tętnicze
≤80–90 mm Hg lub wskaźnik sercowy 2 l/min/m2)
5) pogarszająca się czynność prawej komory.
Zalecenia dotyczące chirurgicznego
wszczepienia urządzenia
wspomagającego czynność lewej
komory u chorych ze skurczową NS
1. Zaleca się wszczepienie urządzenia
wspomagającego czynność lewej komory
lub obu komór u wybranych chorych (p. wyżej)
ze schyłkową NS pomimo optymalnego leczenia
farmakologicznego i ICD lub CRT, którzy kwalifikują
się do przeszczepienia serca – w celu
zmniejszenia nasilenia objawów podmiotowych
oraz ryzyka hospitalizacji z powodu NS i ryzyka
przedwczesnego zgonu w okresie oczekiwania
na transplantację [I/B].
2. Należy rozważyć wszczepienie urządzenia
wspomagającego czynność lewej komory u bardzo
wyselekcjonowanych chorych (p. wyżej) ze schyłkową
NS pomimo optymalnego leczenia farmakologicznego i ICD lub CRT, którzy nie kwalifikują
się do przeszczepienia serca, ale spodziewany
czas przeżycia w dobrym stanie czynnościowym
wynosi >1 rok – w celu zmniejszenia nasilenia
objawów podmiotowych i zmniejszenia ryzyka hospitalizacji z powodu NS i przedwczesnego
zgonu [IIa/B].
Edukacja chorych z niewydolnością serca
Edukacja chorych z niewydolnością serca powinna
obejmować następujące zagadnienia:
1) przyczynę niewydolności serca i występowania
dolegliwości
2) ważne czynniki rokownicze i podejmowanie
realistycznych decyzji
3) monitorowanie objawów podmiotowych i samoleczenie
a) monitorowanie i rozpoznawanie objawów
b) codzienne ważenie i rozpoznawanie szybkiego
przybierania na wadze
c) jak i kiedy powiadamiać lekarza
d) zwiększanie dawki diuretyku lub poinformowanie
lekarza w przypadku nasilenia duszności
lub obrzęków, lub nagłego niespodziewanego
przybrania na wadze >2 kg w ciągu 3 dni
e) umiejętność modyfikowania leczenia moczopędnego w razie potrzeby
4) leczenie farmakologiczne
a) wskazania, dawkowanie i efekty działania
leków
b) rozpoznawanie częstych skutków ubocznych
każdego z przepisanych leków
5) przestrzeganie zaleceń
a) znaczenie przestrzegania zaleceń dotyczących
leczenia i utrzymywania motywacji
b) ograniczenie spożycia sodu, które może
pomóc opanować objawy podmiotowe i przedmiotowe
zastoju krwi u chorych z objawową
niewydolnością serca w III lub IV klasie NYHA
6) dieta
a) unikanie picia nadmiernych ilości płynów. Ograniczenie do 1,5–2 l dziennie można
rozważyć u chorych z ciężką niewydolnością
serca – w celu zmniejszenia objawów podmiotowych i zastoju. Rutynowe ograniczanie
picia płynów u wszystkich chorych z lekkimi
lub umiarkowanymi objawami podmiotowymi
prawdopodobnie nie przynosi korzyści. Ograniczenie picia płynów uzależnione
od masy ciała (30 ml/kg mc., 35 ml/kg mc. u chorych ważących >85 kg) może wiązać
się z mniejszym pragnieniem. Ograniczenie
picia płynów hipotonicznych może skorygować
hiponatremię.
b) monitorowanie i zapobieganie niedożywieniu
c) zdrowe odżywianie się i utrzymywanie odpowiedniej
masy ciała
7) umiarkowane picie alkoholu – abstynencję
zaleca się u chorych z kardiomiopatią alkoholową; u pozostałych chorych zaleca się picie
nie więcej niż 2 jednostek dziennie u mężczyzn i 1 jednostki dziennie u kobiet (1 jednostka to
10 ml czystego alkoholu, np. 1 kieliszek wina,
pół kufla piwa i 1 kieliszek wódki)
8) zaprzestanie palenia tytoniu i przyjmowania
środków psychoaktywnych (narkotyków)
9) wysiłek fizyczny
a) korzyści z wysiłku fizycznego
b) regularne ćwiczenia fizyczne
c) uspokojenie co do możliwości podejmowania
aktywności fizycznej
10) podróże i wypoczynek
a) przygotowanie podróży i aktywności rekreacyjnych
zależnie od wydolności fizycznej
b) posiadanie podczas podróży spisanej historii
choroby i wykazu aktualnie przyjmowanych
leków oraz zapasu leków
c) monitorowanie i dostosowanie podaży płynów,
szczególnie w czasie podróży samolotem i w gorącym klimacie
d) uświadomienie niepożądanych reakcji po ekspozycji
na słońce w przypadku przyjmowania
niektórych leków (np. amiodaronu)
11) aktywność seksualna – chorzy w stanie stabilnym
mogą podejmować normalną aktywność
seksualną, która nie wywołuje dolegliwości
12) szczepienia – szczepienie przeciwko grypie i zakażeniom pneumokokowym zgodnie z lokalnymi
wytycznymi
13) zaburzenia snu i oddychania
a) zapobieganie poprzez zmniejszenie masy
ciała u chorych otyłych, zaprzestanie palenia
tytoniu i picia alkoholu
b) znajomość możliwości leczenia, jeśli jest ono
wskazane
14) aspekty psychospołeczne
a) uświadomienie, że u chorych z NS często
występują objawy depresji i zaburzenia
czynności poznawczych oraz że ważne jest
wsparcie społeczne
b) znajomość możliwości leczenia, jeśli jest
wskazane.











